Objectif : Mettre l’accent sur l’importance de l’autophagie dans le renouvellement cellulaire et la lutte contre le vieillissement et les maladies chroniques (maladies neurodégénératives, maladies métaboliques, maladies cardiovasculaires).
1- C’est quoi l’autophagie :
L’autophagie est un processus biochimique catabolique qui se trouve chez toutes les cellules eucaryotes. Il s’agit d’un mécanisme cellulaire d’auto phagocytose, d’élimination, et de recyclage des cellules dysfonctionnelles, d’agrégats de protéines et des organites cellulaires vieilli et endommagé. Cette dégradation se fait essentiellement par les lysosomes intracellulaires. Ce processus est découvert par la première fois par le chercheur belge Christian de Duve (prix Nobel en médecine) en 1963. Après 30 ans, plusieurs recherches ont fait le lien entre l’autophagie et la protection contre : le vieillissement prématuré, les maladies métaboliques (diabète, obésité) les maladies cardiovasculaires et neurodégénératives. L’altération de ce processus fait l’objet de plusieurs études qui montrent que plusieurs maladies chroniques se caractérisent par une perturbation de l’autophagie.
Au niveau moléculaire, l’autophagie est impliquée dans le recyclage de plusieurs protéines dysfonctionnelles dans les cellules et une altération de l’autophagie qui est associée avec une accumulation de ces protéines dans les cellules induisant un état de stress oxydatif excessif [1].
L’autophagie (ou mitophagie) est aussi impliquée dans le recyclage des mitochondries vieillit et dans la biogenèse mitochondriale qui est un processus crucial dans le maintien de l’homéostasie énergétique [2]. L’autophagie est aussi impliquée dans le fonctionnement du système immunitaire et essentiellement dans l’élimination des agents pathogènes intracellulaires (connue sous le nom de xénophagie) [3].
2- Les différentes étapes et types d’autophagie :
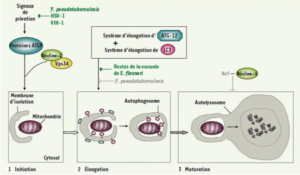
L’autophagie se déroule en 3 étapes : l’initiation, l’élongation, la maturation [4] :
- L’initiation (la macroautophagie) commence généralement au niveau d’une cellule qui contient des organites endommagés ou qui est infecté par des agents pathogènes (virus, bactérie).
- L’élongation (la microautophagie) qui fait intervenir les protéines ATG12 (formé des protéines ATG12, 5 et 16) qui vont s’associer au complexe LC3 pour activer la formation de la bicouche membranaire appelé autophagosome qui s’allonge pour séquestrer l’organite ou la cellule entière.
- La maturation : dans cette étape se produit une fusion entre le phagosome et les lysosomes pour former l’autolysosome ce qui permet la dégradation de l’organite endommagé ou l’agent pathogène.
Schéma expliquant le déroulement de l’autophagie
Il existe 3 types d’autophagie :
- La macro-autophagie se traduit par la phagocytose du contenu cytoplasmique par la formation d’une double membrane lipidique appelée autophagosome qui est éliminé suite à la fusion avec les lysosomes.
- La micro-autophagie se fait essentiellement par les lysosomes qui sont impliqués dans l’élimination des protéines tronquées et des agents pathogènes.
- L’autophagie par chaperon se fait grâce aux lysosomes qui sont activés par des peptides de signalisation localisés au niveau de la membrane.
L’autophagie dite sélective : mitophagy, ERphagy, lipophagy, xenophagy est dirigé vers le recyclage des organites cellulaires (mitochondries, Réticulum endoplasmique, liposomes, agents pathogènes) [5].
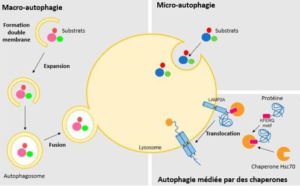
Schéma expliquant Les différents types d’autophagie (autres sources)
3- Les bienfaits de l’autophagie :
- Permet de fournir aux cellules des éléments constitutifs comme les acides aminés.
- Permet le Recyclage des protéines, organites et agrégats endommagés (comme les plaques amyloïdes dans la maladie d’Alzheimer.
- Participe à la régulation de la biogenèse mitochondriale et la lutte contre le stress oxydatif.
- Permet l’Élimination du réticulum endoplasmique endommagé et des peroxysomes.
- Permet de Protéger le système nerveux et favoriser la croissance de nouveau neurones (la neuroplasticité).
- Permet de soutenir la croissance des cellules cardiaques et protéger contre les maladies cardiaques.
- Permet le renforcement du système immunitaire en éliminant les agents pathogènes intracellulaires.
- Permet de lutter contre le cancer, le vieillissement, les maladies neurodégénératives et d’autres maladies.
3-1- Les bienfaits sur le diabète et l’obésité :
Le syndrome métabolique (diabète et obésité) est un problème majeur de santé publique dans le monde et en Tunisie. Les mécanismes physiopathologiques de diabète incluent l’insulino-résistance dans les cellules de muscle squelettiques et l’augmentation de taille de tissus adipeux et la formation des AGES (advanced glycation products). Ces mécanismes engendrent une accumulation de stress oxydatif au niveau intracellulaire et une altération de la fonction mitochondriale. L’autophagie et plus spécifiquement la mitophagie intervient dans le processus de recyclage et d’élimination des mitochondries endommagées, ce qui protège contre l’insulino résistance [6]. Il a été démontré dans une étude sur des souris publiée dans le journal de diabètelogia que la perturbation de l’autophagie dans les cellules pancréatiques bêta induit une accumulation de protéines dysfonctionnels au niveau du réticulum endoplasmique, ce qui augmente le stress oxydatif qui contribue à l’évolution de diabète [7]. Selon un Review publiée dans le journal de experimental and clinical science l’autophagie joue un rôle clé dans la protection contre l’accumulation des AGEs et des mitochondries dysfonctionnelles, ce qui protège contre les complications de diabète (rétinopathie, néphropathie, neuropathie) [8].
3-2- Les bienfaits sur les maladies cardiovasculaires :
Il a été démontré que l’autophagie est nécessaire au bon fonctionnement des cardiomyocytes [9]. Une étude sur des souris a montré que la délétion du gène Atg5 impliqué dans l’activation de l’autophagie dans le myocarde augmente le risque de cardiomyopathie [10]. L’altération de l’autophagie augmente le risque de dysfonctionnement cardiaque et l’hypertrophie du muscle cardiaque. Une étude récente in vivo a montré que l’introduction de micro ARN à des souris inhibe l’autophagie par l’activation de la MTor (mécanistic target of rapamycin) ce qui engendre l’apparition de cardiomyopathie [11].
3-3- Les bienfaits sur les maladies neurodégénératives :
L’autophagie exerce aussi un rôle protecteur du système nerveux en favorisant la neuroplasticité et la biogenèse mitochondriale, en éliminant les agrégats de protéines dysfonctionnels qui jouent un rôle dans la physiopathologie des maladies neurodégénératives comme la sclérose en plaque et la maladie d’Alzheimer [12]. L’accumulation des plaques amyloïdes bêta (observées dans la sclérose en plaque) par exemple inhibe la fusion des autophagosomes avec les lysosomes, ce qui inhibe l’autophagie. Il a été démontré que la mutation dans le gène (PSEN1) qui prédispose à la maladie d’Alzheimer augmente la formation de plaques amyloïde et perturbe l’action des lysosomes [13]. Un Review publié dans le journal de neural régénération research a montré que l’autophagie joue un rôle protecteur contre la dégénérescence des neurones. Les auteurs affirment que l’inhibition de la MTOR dans les cellules gliales exerce un effet anti-inflammatoire, régule le développement des oligodendrocytes et favorise la constitution de la gaine de myéline qui est importante pour le bon fonctionnement des neurones.
3-4- Les bienfaits anti-âge :
D’après un Review publiée dans le journal de frontiers in endocrinology. L’activité de l’autophagie diminue avec le vieillissement en contrepartie . L’autophagie permet de lutter contre le vieillissement prématuré par plusieurs mécanismes : [14]
- En réduisant la production des espèces réactives d’oxygène.
- En réduisant la sénescence cellulaire et l’accumulation des protéines dysfonctionnelles.
- En éliminant les mitochondries endommagées par la mitophagie.
- En assurant la réparation de l’ADN et la stabilité du génome.
- Par l’inhibition de l’activité de la télomérase [14].
3-5- Les bienfaits sur le système immunitaire :
L’autophagie joue un rôle important dans l’immunité inné. Elle facilite la fixation des antigènes endogènes aux récepteurs d’histocompatibilité CMH2 qui sont reconnues par les lymphocytes T CD4. En cas d’infections, les pathogènes intracellulaires sont détruits par les lysosomes grâce à l’autophagie (xénophagie). Plusieurs études affirment la relation entre les infections bactériennes et l’activation de l’autophagie. Par exemple, les infections bactériennes (staphylococcus aureus, et listéria) entraînent l’activation des TLR2 par les antigènes bactériens, ce qui conduit à l’activation de l’autophagie [15]. Il a été démontré que l’activation de récepteur TLR9 par les bactéries active la voie de signalisation AMPK et par la suite l’autophagie [16]. Cependant, certaines bactéries peuvent s’échapper aux mécanismes d’autophagie en inhibant la fusion entre les phagosomes et les lysosomes.
3-6- Les bienfaits de l’autophagie sur le cancer :
Le cancer, maladie caractérisée par la prolifération non contrôlée de cellules anormales, est la première cause de mortalité en France avant les maladies cardiovasculaires. Même si le risque de décéder d’un cancer a diminué, l’incidence et le nombre de décès associés à cette maladie sont en augmentation.
Le rôle de L’autophagie dans le cancer n’est pas encore clair. Des études in vivo sur des souris ont montré que la délétion de certains gènes qui contrôlent l’autophagie favorise l’apparition des tumeurs [17].
Une étude publiée dans le journal de National academy of science a montré que l’augmentation de l’autophagie par l’activation du gène Beclin 1 par la mutagenèse ciblée inhibe la croissance des cellules tumorales du cancer du sein en diminuant l’expression de facteur (HER2) epidermal growth factor receptor 2 (HER2) [18].
Cependant, le micro environnement cellulaire du cancer est très complexe et il peut affecter l’autophagie durant les différents stades de cancer. Durant les premiers stades de cancer, il a été démontré que l’autophagie joue un rôle suppresseur contre le développement des tumeurs par le maintien de la stabilité du génome. Dans les stades avancés du cancer l’autophagie favorise l’entrée des cellules dans la phase G0 ce qui prévient contre l’hyper prolifération des tumeurs [20].
4– Comment activer l’autophagie :
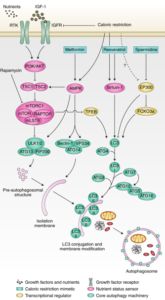
L’activation de l’autophagie inclut plusieurs mécanismes biologiques complexes qui peuvent être stimulé par des molécules naturelles qui se trouvent dans les plantes ou par d’autres mesures comme le jeûne et la restriction calorique [21] :
- La metformine (un médicament anti-diabétique) et la restriction calorique activent l’autophagie par la voie de signalisation AMPK.
- L’inhibition de la protéine Mtor par la Rapamycine (un médicament immunosuppresseur) active l’autophagie.
- La stimulation de la voie de signalisation ERK active l’autophagie
- Le resvératrol favorise l’activation des gènes sirtuines ce qui active le complexe LC3 impliqué dans l’activation de l’autophagie
- La spermidine active l’autophagie par l’intermédiaire de la protéine Ep300
Un schéma illustrant l’activation de l’autophagie par plusieurs molécules naturelles exogènes [21]
4-1- Les molécules extraites à partir des plantes qui activent l’autophagie :
|
Molécule qui active l’autophagie |
Plante |
Voie de signalisation |
Référence de l’étude |
|
La curcumine
|
Curcuma longa |
AKT / Mtor / PCSK9 |
Cellules cancéreuses gliales cultivées in vitro [22] |
|
Le resvératrol
|
Raisins rouges |
AMPK /SRT1 |
Cellules cancéreuses cultivées in vitro [23] |
|
Oleuropein Aglycone (OLE) |
Huile d’olive extra vierge et feuille d’olivier |
Inhibition de la Mtor Et activation de l’AMPK |
Etude rétrospective sur des patients atteints de la maladie d’Alzheimer [24] |
|
Epigallocatechin 3-gallate (EGCG) |
Thé vert |
Inhibition de la Mtor Et activation de la AMPK |
Etude in vitro [25] |
|
Apigenin
|
Persil, le plantain, l’achillée millefeuille, le romarin |
mTOR/AMPK/ULK1 |
Etude sur un modèle de souris [26] |
|
Capsaicine
|
Poivre rouge |
L’augmentation de complexe LC3 ET l’inhibition de la Mtor et Pi3k |
Étude sur des Cellules cancéreuse humaine cultivées in vitro[27] |
|
Ginsenoside K
|
Ginseng (plante chinoise) |
Inhibition de la Mtor |
Astrocytes de souris atteint (un modèle de la maladie d’Alzheimer) [28] |
|
Acide Ursolique |
Romarin et thym |
En inhibant la Mtor et la protéine AKT |
Cellules cancéreuses humaines cultivées in vitro [29] |
4-2- L’hormèse pour activer l’autophagie :
L’autophagie est un processus cryoprotecteur qui peut être activé par plusieurs mécanismes : le stress oxydatif aigu, le jeûne, l’exercice physique et le sauna.
- L’exercice physique :
Les bienfaits de l’exercice physique ne sont plus à démontrer. En plus de ces effets antidépresseurs (par l’intermédiaire de la sécrétion des endorphines). L’exercice physique active l’autophagie. En effet, selon une étude in vivo sur des rats publiée dans le journal de autophagy, L’exercice physique stimule l’autophagie en activant la voie de signalisation AMPK. Cette activation se fait dans le cortex cérébral, les tissus adipeux, les muscles, le foie et le pancréas. [30]. L’exercice physique modéré (30 minutes par jour) constitue une forme de stress bénéfique pour l’organisme : C’est l’hormèse. La production d’espèce réactive d’oxygène pendant l’exercice physique active aussi la biogenèse mitochondriale et la détoxification cellulaire par l’intermédiaire du facteur NRF2 ce qui apporte des bénéfices supplémentaires.
- Le jeûne intermittent :
Le jeune : en arrêtant de manger pendant 14 à 20 heures, notre corps active plusieurs voies de signalisations impliquées dans la réparation, la régénération et la détoxification. Notre système digestif consomme beaucoup d’énergie et il a besoin d’un peu de repos de temps en temps. Le jeûne constitue une approche efficace pour activer l’autophagie. Selon une étude publiée dans le journal de Autophagy sur un modèle de souris, le jeune pendant de périodes allant de 24 à 48 heures active l’autophagie dans le foie en inhibant la protéine Mtor. Les chercheurs ont constaté une augmentation du nombre d’autophagosomes dans les neurones corticaux des souris pendant le jeûne [31].
- Le sauna :
Le sauna est aussi une forme d’hormèse. Notre corps possède une capacité d’adaptation formidable aux températures extrêmes. C’est notre système de thermorégulation. En effet, le sauna active aussi plusieurs gènes impliqués dans la réparation de l’ADN et la détoxification comme le NRF2 et la FOXO3. Le sauna active la formation des protéines HSP heat shock protéines qui protègent contre la formation d’agrégats de protéine, ce qui protège contre les maladies neurodégénératives. Un Review récent publié dans le journal de applied physiology montre que les conditions d’hyperthermie comme le sauna active l’autophagie, ce qui exerce un effet anti-âge et protecteurs contre le développement de plusieurs maladies chroniques [32].
Références
[1] M. Komatsu, S. Waguri, T. Ueno, J. Iwata, S. Murata, I. Tanida, et al., Impairment of starvation-induced and constitutive autophagy in Atg7-deficient mice, J. Cell. Biol. 169 (2005) 425–434.
[2] Palikaras K, Tavernarakis N. Mitochondrial homeostasis: the interplay between mitophagy and mitochondrial biogenesis. Exp Gerontol. 2014 Aug;56:182-8. doi: 10.1016/j.exger.2014.01.021. Epub 2014 Jan 28. PMID: 24486129.
[3] Bauckman KA, Owusu-Boaitey N, Mysorekar IU. Selective autophagy: xenophagy. Methods. 2015 Mar;75:120-7. doi: 10.1016/j.ymeth.2014.12.005. Epub 2014 Dec 11. PMID: 25497060; PMCID: PMC4355331.
[4] Le Roux D, Niedergang F. Autophagie et micro-organismes [« Autophagy and microorganisms »: hotspots of a mini-symposium]. Med Sci (Paris). 2010 May;26(5):534-7. French. doi: 10.1051/medsci/2010265534. PMID: 20510155.
[5] C. He, D.J. Klionsky, Regulation mechanisms and signaling pathways of autophagy, Annu. Rev. Genet. 43 (2009) 67–93.
[6] L. Yang, P. Li, S. Fu, E.S. Calay, G.S. Hotamisligil, Defective hepatic autophagy in obesity promotes ER stress and causes insulin resistance, Cell Metab. 11 (2010) 467–478.
[7] W. Quan, K.Y. Hur, Y. Lim, S.H. Oh, J.C. Lee, K.H. Kim, et al., Autophagy deficiency in beta cells leads to compromised unfolded protein response and progression from obesity to diabetes in mice, Diabetologia 55 (2012) 392–403.
[8] Bhattacharya D, Mukhopadhyay M, Bhattacharyya M, Karmakar P. Is autophagy associated with diabetes mellitus and its complications? A review. EXCLI J. 2018;17:709-720. Published 2018 Jul 24. doi:10.17179/excli2018-1353.
[9] A. Terman, U.T. Brunk, Autophagy in cardiac myocyte homeostasis, aging, and pathology, Cardiovasc. Res. 68 (2005) 355–365.
[10] A. Nakai, O. Yamaguchi, T. Takeda, Y. Higuchi, S. Hikoso, M. Taniike, et al., The role of autophagy in cardiomyocytes in the basal state and in response to hemodynamic stress, Nat. Med. 13 (2007) 619–624.
[11] Z. Li, Y. Song, L. Liu, N. Hou, X. An, D. Zhan, et al., miR–199a impairs autophagy and induces cardiac hypertrophy through mTOR activation, Cell Death Differ. 24 (2017) 1205–121.
[12] Y.S. Rajawat, I. Bossis, Autophagy in aging and in neurodegenerative disorders, Hormones (Athens) 7 (2008) 46–61.
[13] E. Kesidou, R. Lagoudaki, O. Touloumi, K.N. Poulatsidou, C. Simeonidou, Autophagy and neurodegenerative disorders, Neural. Regen. Res. 8 (2013) 2275–2283.[14] Barbosa María Carolina, Grosso Rubén Adrián, Fader Claudio Marcelo Hallmarks of Aging: An Autophagic Perspective JOURNAL=Frontiers in Endocrinology VOLUME=9 YEAR=2019 PAGES=790; URL=https://www.frontiersin.org/article/10.3389/fendo.2018.00790 DOI=10.3389/fendo.2018.00790.
[15] T. Into, M. Inomata, E. Takayama, T. Takigawa, Autophagy in regulation of Tolllike receptor signaling, Cell Signal. 24 (2012) 1150–1162.
[16] T. Oka, S. Hikoso, O. Yamaguchi, M. Taneike, T. Takeda, T. Tamai, et al., Mitochondrial DNA that escapes from autophagy causes inflammation and heart failure, Nature 485 (2012) 251–255.
[17] Yue Z, Jin S, Yang C, et al. Beclin 1, an autophagy gene essential for early embryonic development, is a haploinsufficient tumor suppressor. Proc Natl Acad Sci USA 2003 ; 100 : 15077–15082.
[18] Vega-Rubín-de-Celis S, Zou Z, Fernández ÁF, Ci B, Kim M, Xiao G, Xie Y, Levine B. Increased autophagy blocks HER2-mediated breast tumorigenesis. Proc Natl Acad Sci U S A. 2018 Apr 17;115(16):4176-4181. doi: 10.1073/pnas.1717800115. Epub 2018 Apr 2. PMID: 29610308; PMCID: PMC5910832.
[19] Yun CW, Lee SH. The Roles of Autophagy in Cancer. Int J Mol Sci. 2018;19(11):3466. Published 2018 Nov 5. doi:10.3390/ijms19113466.
[20] atergnani S, Missiroli S, Marchi S, Giorgi C (2015) Mitochondria-associated endoplasmic reticulum membranes microenvironment: targeting autophagic and apoptotic pathways in cancer therapy. Front Oncol 5:173.
[21] Leidal, A.M., Levine, B. & Debnath, J. Autophagy and the cell biology of age-related disease. Nat Cell Biol 20, 1338–1348 (2018). https://doi.org/10.1038/s41556-018-0235-8.
[22] Aoki H., Takada Y., Kondo S., Sawaya R., Aggarwal B.B., Kondo Y. Evidence that curcumin suppresses the growth of malignant gliomas in vitro and in vivo through induction of autophagy: Role of Akt and extracellular signal-regulated kinase signaling pathways. Mol. Pharmacol. 2007;72:29–39. doi: 10.1124/mol.106.033167.
[23] Tian Y, Song W, Li D, Cai L, Zhao Y. Resveratrol As A Natural Regulator Of Autophagy For Prevention And Treatment Of Cancer. Onco Targets Ther. 2019;12:8601-8609. Published 2019 Oct 17. doi:10.2147/OTT.S213043.
[24] Cordero JG, García-Escudero R, Avila J, Gargini R, García-Escudero V. Benefit of Oleuropein Aglycone for Alzheimer’s Disease by Promoting Autophagy. Oxid Med Cell Longev. 2018 Feb 20;2018:5010741. doi: 10.1155/2018/5010741. PMID: 29675133; PMCID: PMC5838478.
[25] Holczer M, Besze B, Zámbó V, Csala M, Bánhegyi G, Kapuy O. Epigallocatechin-3-Gallate (EGCG) Promotes Autophagy-Dependent Survival via Influencing the Balance of mTOR-AMPK Pathways upon Endoplasmic Reticulum Stress. Oxid Med Cell Longev. 2018;2018:6721530. Published 2018 Jan 31.doi:10.1155/2018/6721530
[26] Zhang X, Bu H, Jiang Y, Sun G, Jiang R, Huang X, Duan H, Huang Z and Wu Q: The antidepressant effects of apigenin are associated with the promotion of autophagy via the mTOR/AMPK/ULK1 pathway. Mol Med Rep 20: 2867-2874, 2019.
[27] In YT, Wang HC, Hsu YC, Cho CL, Yang MY, Chien CY. Capsaicin Induces Autophagy and Apoptosis in Human Nasopharyngeal Carcinoma Cells by Downregulating the PI3K/AKT/mTOR Pathway. Int J Mol Sci. 2017 Jun 23;18(7):1343. doi: 10.3390/ijms18071343. PMID: 28644386; PMCID: PMC5535836.
[28] Guo J, Chang L, Zhang X, Pei S, Yu M, Gao J. Ginsenoside compound K promotes β-amyloid peptide clearance in primary astrocytes via autophagy enhancement. Exp Ther Med. 2014;8(4):1271-1274. doi:10.3892/etm.2014.1885.
[29] Castrejón-Jiménez NS, Leyva-Paredes K, Baltierra-Uribe SL, et al. Ursolic and Oleanolic Acids Induce Mitophagy in A549 Human Lung Cancer Cells. Molecules. 2019;24(19):3444. Published 2019 Sep 23. doi:10.3390/molecules24193444
[30] He C, Sumpter R Jr, Levine B. Exercise induces autophagy in peripheral tissues and in the brain. Autophagy. 2012;8(10):1548-1551. doi:10.4161/auto.21327.
[31] Holczer M, Besze B, Zámbó V, Csala M, Bánhegyi G, Kapuy O. Epigallocatechin-3-Gallate (EGCG) Promotes Autophagy-Dependent Survival via Influencing the Balance of mTOR-AMPK Pathways upon Endoplasmic Reticulum Stress. Oxid Med Cell Longev. 2018;2018:6721530. Published 2018 Jan 31.doi:10.1155/2018/6721530
[32] McCormick, J. J., Dokladny, K., Moseley, P. L., & Kenny, G. P. (2020). Autophagy and heat: a potential role for heat therapy to improve autophagic function in health and disease. Journal of Applied Physiology. doi:10.1152/japplphysiol.00542.2.
Autres sources :
Corbier, Camille. (2019). Caractérisation d’un modèle murin knock out pour le gène C9orf72.