Sommaire :
1- C’est quoi le Leakey Gut syndrome :
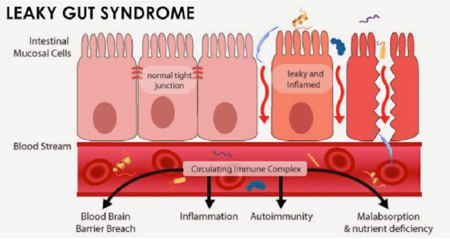
L’hyperperméabilité intestinale ou Leakey Gut syndrome est une pathologie digestive qui se caractérise par la perturbation des jonctions serrées entre les cellules épithéliales intestinales. Ceci se manifeste par une perméabilité intestinale anormale qui entraine le passage des macromolécules non digéré et les sous métabolites du macrobiote comme (les lipopolysaccharides) vers le sang déclenchant une réponse immunitaire inflammatoire. Les symptômes de cette maladie sont variables : ballonnement et gaz, allergies alimentaires, fatigue et problèmes cutanés [1].
Avec l’émergence de l’alimentation ultra-transformée et de beaucoup de plats préparés, cette maladie est devenue de plus en plus prévalente. C’est un fléau de santé dans les pays industriels. Elle augmente le risque de développement des maladies auto-immunes. Nous allons découvrir que cette pathologie est déclenchée essentiellement par la diète alimentaire déséquilibrée.
2- La physiopathologie et les causes :
La barrière intestinale est maintenue par plusieurs parties qui contiennent des cellules spécialisées.
- La muqueuse et le glycocalyx qui inhibent l’adhésion des souches bactériennes pathogènes aux cellules épithéliales par l’intermédiaire de la sécrétion des anticorps IGA. La muqueuse contient des cellules spécialisées appelées cellules de globlet qui secrètent les mucines (des macromolécules recouvrant les cellules en contact avec le milieu extérieur et protégeant les épithéliums contre toutes sortes d’agressions d’origine endogène ou exogène (sucs digestifs, microorganismes, polluants, toxines…)).
- Le lumina propria est la partie intérieure de cette muqueuse qui contient le système immunitaire inné responsable de la sécrétion des chimiokines, des IGA et il englobe les mastocytes.
- Les cellules épithéliales intestinales sont connectées par des jonctions apicales qui empêchent la migration des endotoxines bactériennes par voie paracellulaire. Il est connu que certaines bactéries probiotiques comme Bifidobacteria et champignons boulardii permettent de maintenir l’intégrité entre ces jonctions. Par contre, d’autres bactéries comme Echerchia coli entéropathogène activent une protéine appelée zonuline qui favorise l’éloignement entre ces jonctions et perturbent l’intégrité de la barrière.
- Les cellules de paneth localisé entre les entérocytes intestinales produisent des peptides défensifs antibactériens qui limitent la multiplication des souches à gram+.
Plusieurs autres facteurs peuvent favoriser l’hypersécrétion de la zonuline comme l’exposition prolongée au gluten du blé ou là sur croissance de bactéries pathogènes dans l’intestin connue sous le nom de SIBO ( small intestinal bacterial overgrowth) , c’est la dysbiose intestinale[2]. Certaines endotoxines bactériennes comme Zonula occluden secrété par Vibrio choléra va aggraver le problème et activer la zonuline.
L’hyperperméabilité intestinale entraine une activation d’une réaction immunitaire spécifique contre les macromolécules qui migrent vers le sang. Entrainant une inflammation locale et même systémique. Il a été démontré que l’hyper activation de la zonuline est observé dans Plusieurs maladies inflammatoires du tube digestif comme (la maladie de Crohn, la colite ulcéreuse, le syndrome d’intestin irritable) mais aussi dans plusieurs maladies auto-immunes comme le diabète de type 1 et la sclérose en plaque, les maladies de la peau (l’eczéma, le psoriasis) et même les maladies neuropsychiatriques comme la dépression et la schizophrénie !! [2].
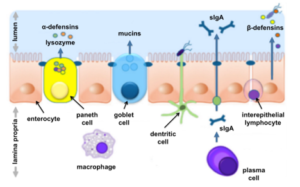
Ci-joint un schéma expliquant le rôle des différentes cellules dans le maintien de l’intégrité de la barrière intestinale.
- Causes de leaky gut syndrome
– parmi les causes les plus communes, on peut citer [3] :
- Le régime alimentaire déséquilibré : régime hypercalorique, riche en sucres raffinés et pauvre en micronutriments, ou encore un régime riche en lipides.
- Les émulsifiants continuent dans les aliments ultra-transformés provoquent une hyperperméabilité intestinale.
- Les intolérances alimentaires : au Gluten de Blé, à la caséine du lait, lectines et l’acide phytique des céréales et des légumineuses.
- Le stress chronique et le stress oxydatif.
- L’utilisation fréquente des anti-inflammatoires non stéroïdiens.
- L’obstruction biliaire.
- Les infections chroniques.
- La dysbiose intestinale causée par l’utilisation prolongée des antibiotiques [4].
- L’alcool et le tabac
- La prédisposition génétique
3- Traitement naturel de leaky Gut syndrome :
L’approche intégrative du traitement de l’hyperperméabilité intestinale inclus :
3-1-L’adoption du régime sans gluten :
Adoptez un régime sans gluten à base de céréales germé non génétiquement modifié ( blé kamut, riz sauvage , avoine) est une stratégie efficace pour combattre l’hyperperméabilité intestinale. En effet, il a démontré que la gliadine du gluten permet d’activer les récepteurs de zonuline IEC6, et Caco2 qui augmente l’hyperperméabilité intestinale [5],[6].
Selon une revue publiée dans le journal de Nutrients l’adoption de régime sans gluten permet de moduler la composition du microbiote intestinale en faveur de la prévention contre la dysbiose. Une étude clinique randomisée incluse dans la revue a montré que l’adoption d’un régime Low Fod Map pendant 2 semaines suivi d’un régime sans gluten augmente la variabilité dans la composition du microbiote (diminution du genre Lachnospiraceae et augmentation des bactériodes). Le régime aussi a provoqué une réduction dans le pourcentage des lymphocytes dans l’espace intradudénale et une réduction de la production du mucus par les cellules Globlet [7]. Une étude clinique randomisée publiée dans le journal de Gastroentérology a montré que le suivi d’un régime contenant du gluten pendant 4 semaines chez 45 patients atteint de syndrome d’intestin irritable entraine une altération dans la perméabilité intestinale chez les individus à phénotype HLA-DQ2/8-. Cette altération est tout à fait réversible en adoptant un régime sans gluten [8].
3-2- La consommation de probiotiques et les aliments fermentés :
Notre macrobiote intestinal est composée d’une communauté bactérienne diverse : la partie proximale de l’intestin contient les souches de Streptococcaceae et Lactobacillaceae alors que la partie distale contient la famille des Lactobacillaceae, Erysipelotrichaceae, et Enterobacteriaceae. Le colon contient la famille des Bacteriodaceae, Prevotellaceae, et Clostridiaceae . En cas de dysbiose la répartition de ces différentes familles change ce qui perturbe l’homéostasie entrainant l’émergence des souches pathogènes qui vont altérer le fonctionnement de la barrière intestinale.
La consommation des aliments fermentés comme : le Miso, la vinaigre de kombuha, le kéfir, la choucroute permettent d’assurer la fonction et l’intégrité de la barrière intestinale. Une Revue récente publiée dans le journal de Nutrients et qui résume 19 études cliniques randomisées a montré que la consommation des aliments fermentés provoque des changements dans la diversité du microbiote intestinal [9], les chercheurs ont mentionné que la consommation de ces aliments et une stratégie efficace pour combattre la dysbiose intestinale.
Une étude clinique randomisée a analysé le microbiote intestinal après consommation de lait fermenté chez 28 femmes atteintes du syndrome du côlon irritable (IBS). Après l’intervention, les chercheurs ont observé une diminution de Bilophila wadsworthia (une bactérie pathogène) et une augmentation des bactéries productrices de butyrate. et une augmentation de la production des acides gras à chaîne courte dans l’intestin [10].
3-3- Adoptez le jeune intermittent (16-8) :
Pendant le jeune les microlésions dans les cellules épithéliales intestinales se réparent et la muqueuse se régénère et le taux des bactéries probiotiques du microbiote intestinal augmente. En effet, une étude clinique réalisée a Turquie sur 9 individus sains. A montré que le jeune intermittent islamique durant 17 heures entraine une augmentation dans l’abondance des souches probiotiques ( Akkermancia . muciniphila et Bacteroide . fragilis) . [11]
3-4-Essayez le bouillant d’os riche collagène :
Le bouillon d’os est une soupe formée par la cuisson douce et prolongé dans l’eau des tendons, des cartilages, et des os de poulet ou d’animaux ruminants ( mouton, bœuf). Pendant 4 à 8 heures, cette soupe constitue une bonne source de micronutriments à propriété anti-inflammatoire et réparatrice des intestins. Elle contient plusieurs sels minéraux (calcium, potassium, magnésium, sodium, phosphore, zinc, cuivre) mais aussi des acides aminés comme (Glycine, proline, glutamine) qui forment le collagène, ce dernier favorise la réparation de l’atrophie des microvillosités intestinales. Lors de la cuisson le collagène est réduit en gélatine qui va donner l’aspect gélatineux de bouillon d’os. Une étude publiée sur un modèle de souris atteintes de colite ulcéreuse a montré que la gélatine améliore l’intégrité de la barrière intestinale et la muqueuse [12]. Il a été démontré aussi dans une étude in vitro réalisée sur des cellules épithéliales intestinales que la gélatine et la glycine réduisent l’inflammation intestinale causée par les lipopolysaccharides [13].
L’acide aminé glycine continue dans le bouillon d’os est essentiel pour la digestion. Il aide dans la formation de l’acide chlorhydrique dans l’estomac qui est crucial pour prévenir contre le reflux gastro-œsophagien. Mais aussi. Il aide dans la formation des acides biliaires impliqués dans la digestion des lipides. La gélatine permet la rétention des fluides dans les intestins ce qui améliore la motilité et supporte la barrière intestinale.
3-5- La L-glutamine pour la réparation de la muqueuse intestinale :
La L -glutamine est un acide aminé que le corps a besoin pour la réparation des entérocytes au niveau de ‘l’intestin. Bien que le corps fabrique de la glutamine à partir des protéines ingérées. Il arrive parfois que les besoins augmentent face à un apport non optimal. Une étude sur des modèles animales publiée dans le journal de curent opinions in nutrition and metabolism a montré que la déplétion de glutamine dans l’intestin entraine une atrophie des microvillosités et une hyperperméabilité intestinale [14]. Les sources de L-glutamine : bouillon d’os, viande, poisson, tendons et tissus conjonctifs des animaux. Les compléments alimentaires de L-Glutamine : (ne pas dépasser 5 grammes par jour)
3-6- Inclure les aliments riches en acides gras oméga 3 :
(Poissons gras, sardines, saumons, maquereau, huile d’olive, graine de chia, graine de lin). En effet, les acides gras oméga 3, EPA (eicosapentaenoic acide) et (DHA docosahexaenoic acide) et l’acide alpha linolénique en particulier possèdent des propriétés anti-inflammatoires en inhibant les facteurs proinflammatoires (cyclooxygénase, NFKB). Ces acides gras s’incorporent dans la composition de la membrane des cellules épithéliales intestinale et inhibent l’hyperperméabilité [15]. En plus des acides gras oméga 3 peuvent exercer un effet bénéfique sur notre microbiote intestinal, selon une Revue récente, la supplémentation en acides gras oméga 3 augmente le taux de bactéroides et des bactéries productrices de butyrate qui appartiennent à la famille des Lachnospiraceae. Les études sur les modèles animales montrent que les acides gras oméga 3 augmentent la production des acides gras à chaine courte (butyrate, acétate) par les bactéries probiotiques ce qui inhibe la multiplication des bactéries pathogènes [16].
3-7- Évitez les régimes hypercaloriques :
Les régimes hypercaloriques riches en glucides raffinés et en lipides à la fois déclenchent une réaction inflammatoire et peuvent induire une hyperperméabilité intestinale. Selon une étude sur des souris Les acides gras trans en particulier ceux continu dans les huiles hydrogénées et la margarine contribuent en majeure partie à l’inflammation intestinale et peuvent même exacerber le dysfonctionnement métabolique et la stéatose hépatique [17]. Ces effets sont encore aggravés par la consommation d’un régime riche en sucres.
Il faut noter que la consommation modérée des acides gras polyinsaturés et mono-insaturés continue dans l’huile d’olive, les noix et les amandes est tout à fait encouragé pour combattre l’inflammation. Les acides gras saturés aussi dans les produits animaux peuvent être consommé avec modération en combinaison avec les acides gras oméga 3
Références :
[1] Arrieta MC, Bistritz L, Meddings JB. Alterations in intestinal permeability. Gut. 2006;55(10):1512-1520. doi:10.1136/gut.2005.085373.
[2] Fasano A. All disease begins in the (leaky) gut: role of zonulin-mediated gut permeability in the pathogenesis of some chronic inflammatory diseases. F1000Res. 2020;9:F1000 Faculty Rev-69. Published 2020 Jan 31. doi:10.12688/f1000research.20510.1
[3] Camilleri M. Leaky gut: mechanisms, measurement and clinical implications in humans. Gut. 2019 Aug;68(8):1516-1526. doi: 10.1136/gutjnl-2019-318427. Epub 2019 May 10. PMID: 31076401; PMCID: PMC6790068.
[4] Viljoen M, Panzer A, Willemse N. Gastro intestinal hyperpermeability: a review. East Afr Med J. 2003 Jun;80(6):324-30. doi: 10.4314/eamj.v80i6.8710. PMID: 12953743.
[5] Drago S, El Asmar R, Di Pierro M, Grazia Clemente M, Tripathi A, Sapone A, Thakar M, Iacono G, Carroccio A, D’Agate C, Not T, Zampini L, Catassi C, Fasano A. Gliadin, zonulin and gut permeability: Effects on celiac and non-celiac intestinal mucosa and intestinal cell lines. Scand J Gastroenterol. 2006 Apr;41(4):408-19. doi: 10.1080/00365520500235334. PMID: 16635908.
[6] Lammers KM, Lu R, Brownley J, Lu B, Gerard C, Thomas K, Rallabhandi P, Shea-Donohue T, Tamiz A, Alkan S, Netzel-Arnett S, Antalis T, Vogel SN, Fasano A. Gliadin induces an increase in intestinal permeability and zonulin release by binding to the chemokine receptor CXCR3. Gastroenterology. 2008 Jul;135(1):194-204.e3. doi: 10.1053/j.gastro.2008.03.023. Epub 2008 Mar 21. PMID: 18485912; PMCID: PMC2653457.
[7] Caio G, Lungaro L, Segata N, Guarino M, Zoli G, Volta U, De Giorgio R. Effect of Gluten-Free Diet on Gut Microbiota Composition in Patients with Celiac Disease and Non-Celiac Gluten/Wheat Sensitivity. Nutrients. 2020 Jun 19;12(6):1832. doi: 10.3390/nu12061832. PMID: 32575561; PMCID: PMC7353361.
[8] Vazquez-Roque MI, Camilleri M, Smyrk T, Murray JA, Marietta E, O’Neill J, Carlson P, Lamsam J, Janzow D, Eckert D, Burton D, Zinsmeister AR. A controlled trial of gluten-free diet in patients with irritable bowel syndrome-diarrhea: effects on bowel frequency and intestinal function. Gastroenterology. 2013 May;144(5):903-911.e3. doi: 10.1053/j.gastro.2013.01.049. Epub 2013 Jan 25. PMID: 23357715; PMCID: PMC3633663.
[9] Stiemsma LT, Nakamura RE, Nguyen JG, Michels KB. Does Consumption of Fermented Foods Modify the Human Gut Microbiota? J Nutr. 2020 Jul 1;150(7):1680-1692. doi: 10.1093/jn/nxaa077. PMID: 32232406; PMCID: PMC7330458.
[10] Eiga P,Pons N Agrawal A , Oozeer R , Guyonnet D , Brazeilles R , Faurie J-M ,van Hylckama Vlieg JET, Houghton LA , Whorwell PJ et al. . Changes of the human gut microbiome induced by a fermented milk product Sci Rep . 2014 4 :6328.
[11] Özkul C, Yalınay M, Karakan T. Islamic fasting leads to an increased abundance of Akkermansia muciniphila and Bacteroides fragilis group: A preliminary study on intermittent fasting. Turk J Gastroenterol. 2019 Dec;30(12):1030-1035. doi: 10.5152/tjg.2019.19185. PMID: 31854308; PMCID: PMC6924600.
[12] Scaldaferri, Franco et al. “Gelatin tannate ameliorates acute colitis in mice by reinforcing mucus layer and modulating gut microbiota composition: Emerging role for ‘gut barrier protectors’ in IBD?.” United European gastroenterology journal vol. 2,2 (2014): 113-22. doi:10.1177/2050640614520867.
[13] Frasca G, Cardile V, Puglia C, Bonina C, Bonina F. Gelatin tannate reduces the proinflammatory effects of lipopolysaccharide in human intestinal epithelial cells. Clin Exp Gastroenterol. 2012;5:61-67. doi:10.2147/CEG.S28792.
[14] Achamrah N, Déchelotte P, Coëffier M. Glutamine and the regulation of intestinal permeability: from bench to bedside. Curr Opin Clin Nutr Metab Care. 2017 Jan;20(1):86-91. doi: 10.1097/MCO.0000000000000339. PMID: 27749689.
[15] Durkin LA, Childs CE, Calder PC. Omega-3 Polyunsaturated Fatty Acids and the Intestinal Epithelium-A Review. Foods. 2021;10(1):199. Published 2021 Jan 19. doi:10.3390/foods10010199 .
[16] Costantini L, Molinari R, Farinon B, Merendino N. Impact of Omega-3 Fatty Acids on the Gut Microbiota. Int J Mol Sci. 2017 Dec 7;18(12):2645. doi: 10.3390/ijms18122645. PMID: 29215589; PMCID: PMC5751248.
[17] Takuro Okamura1, Yoshitaka Hashimoto1, Saori Majima1, Takafumi Senmaru1, Emi Ushigome1, Naoko Nakanishi1, Mai Asano1, Masahiro Yamazaki1, Hiroshi Takakuwa2, Masahide Hamaguchi1* and Michiaki Fukui1 Trans Fatty Acid Intake Induces Intestinal Inflammation and Impaired Glucose Tolerance Front. Immunol., 29 April 2021 | https://doi.org/10.3389/fimmu.2021.669672