Objectifs :
- Mettre l’accent sur le nouveau concept de la génomique nutritionnelle
- Identifier les différents polymorphismes génétiques qui affectent l’absorption et la biodisponibilité de certains micronutriments.
- L’intégration de la biologie des systèmes dans la recherche en nutrition.
- Identifier les polymorphismes génétiques qui nous prédisposent aux maladies.
- L’application de la science de génomique et métabolomiques pour comprendre les différentes voies de signalisation impliquées dans la physiopathologie des maladies chroniques.
1- C’est quoi la génomique nutritionnelle :
La génomique nutritionnelle est une nouvelle discipline en cours de recherche qui vise à étudier l’influence de l’alimentation sur nos gènes. Cette approche consiste à personnaliser la nutrition et les besoins en micronutriments (vitamines et sels minéraux) selon la prédisposition génétique des individus. Certains polymorphismes génétiques affectent les enzymes responsables de l’absorption et la conversion de micronutriments en une forme utilisable par l’organisme.
Plusieurs gènes peuvent présenter ces polymorphismes et augmenter la prédisposition aux maladies et aux carences.
On peut citer :
- L’APOE : affecte le métabolisme de cholestérol.
- Le MTHFR : qui affecte le métabolisme de la vitamine B9 et l’homocystéine.
- FOXO3 : qui affecte la résistance des cellules au stress oxydatif et la longévité.
- FADS2 : qui affecte la conversion des acides gras oméga 3 ALA en EPA.
- FUT2 : qui affecte l’absorption de la vitamine B12.
- NBPF3 : qui affecte la concentration de la vitamine B6.
- BCMO3 : qui affecte la conversion de bêta carotène en vitamine A.
- PEMT : qui affecte la synthèse de phosphatidylcholine dans le foie.
- CYP2R1 : qui affecte la conversion de la vitamine D en une forme utilisable par les cellules.
2- Les objectifs de la nutrition génomique :
- Établir une approche intégrative et personnalisée dans la nutrition.
- L’intégration de la biologie des systèmes dans la recherche en nutrition.
- Identifier les polymorphismes génétiques qui nous prédisposent aux maladies.
- L’application de la science de génomique et métabolomiques pour comprendre les différentes voies de signalisation impliquées dans la physiopathologie des maladies chroniques.
- Établir l’interaction entre les micronutriments et l’expression de gènes par les techniques de génétique moléculaire comme la PCR, la PCR en temps réel, le séquençage à haut débit NGS.
Rappels sur quelques notions de la génétique :
- ADN : séquence nucléotidique qui constitue le support de l’information génétique.
- ARN : L’acide ribonucléique ou ARN est un acide nucléique présent chez pratiquement tous les êtres vivants, et
- Aussi chez certains virus. L’ARN est synthétisé à partir de l’ADN par un processus appelé transcription grâce à l’ARN polymérase.
- Gène : c’est un segment d’ADN (support de l’information génétique).
- Allèle : ce sont les différentes versions d’un même gène.
- Polymorphismes génétiques (c’est la coexistence de plusieurs allèles pour un gène bien déterminé, les variations génétiques proviennent du changement d’une base au niveau du gène).
- PCR : amplification de l’ADN par chaîne. Grâce à l’ADN polymérase.
3- Les différents polymorphismes génétiques décrites dans la littérature en rapport avec la génomique nutritionnelle :
3-1- Les polymorphismes associés avec l’augmentation de risque de maladies cardiovasculaire :
● APOE :
L’APOE est un gène impliqué dans la synthèse de la lipoprotéine E impliqué dans le métabolisme de Cholestérol et plus spécifiquement le LDL cholestérol. La variation dans le gène de L’APOE peut affecter le taux de cholestérol dans le sang. Les taux de cholestérol plasmatique, de cholestérol LDL sont plus élevés chez les sujets porteurs de l’allèle apoE4. Les porteurs de l’allèle APOE 4 présentent une élévation du cholestérol lors de la consommation d’un régime alimentaire riche en cholestérol et acides gras saturé comme le régime cétogène. Par contre, les non porteurs de l’allèle APOE 4 ne présentent pas ce risque qui augmente la prédisposition à l’athérosclérose [1]. D’autres facteurs peuvent affecter l’augmentation de LDL cholestérol comme l’exercice physique et les micronutriments [2], c’est pourquoi le régime riche en acides gras saturés n’est pas nocif pour tout le monde.
● APOEB :
Le gène de l’APOB est localisé sur le chromosome 2 et il est responsable de la synthèse des lipoprotéines B qui se lie au chylomicron et au LDL et VLDL impliquées dans l’absorption et le transport de cholestérol.
Un Review publié dans le journal de Arteriosclerosis montre que certaines mutations comme la substitution d’une base nucléotidique de G en A sur l’exon 26 augmente le risque d’hypercholestérolémie de 40 pourcents chez les hommes et 20 pourcent chez les femmes ce qui augmente le risque d’athérosclérose [3].
● L’APOA :
Le gène de l’APOB est localisé sur le chromosome 11 et il est responsable de la synthèse des lipoprotéines A qui est le constituant majeur de lipoprotéine HDL et l’acétyl transférase.
Une mutation par substitution de G à A (G/A) en amont du site de début de transcription du gène APOA1 a été largement étudiée. Les études ont rapporté que ce polymorphisme était associé à apoA-I et HDL-C. Les individus porteurs de l’allèle APOE A avec cette mutation présentent des taux plus élevés de HDL cholestérol ce qui diminue le risque d’artérosclérose et de maladies cardiovasculaires [4].
3-2- Les polymorphismes génétiques associés avec la biodisponibilité, le métabolisme et la distribution de certains nutriments essentiels :
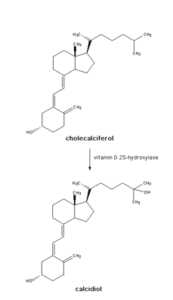
- CYP2R1 (essentiel pour la conversion de la vitamine D) : le cytochrome P450 est un gène qui code pour une enzyme dans le foie appelévitamine D 25-hydroxylase qui catalyse la réaction de transformation de vitamine D3 en Calcidiol 25 OH une forme utilisable par l’organisme. Les mutations au niveau de ce gène induisent une déficience en vitamine D et sont associées avec le rachitisme (un trouble dans la formation des ossatures chez les enfants [5]. Selon un Review publié dans British Médical journal la mutation au niveau de ce gène est associé avec un taux de mortalité élevé [6].
Rappel sur la conversion de la vitamine D3 :
La vitamine D3 ou cholécalciférol est une vitamine liposoluble. Son apport se fait de manière exogène par l’alimentation et endogène par l’exposition au soleil. La vitamine D2 ou ergocalciférol est présente en petite quantité dans de nombreux aliments tels que les céréales et les champignons.
Les vitamines D2 et D3 se métabolisent dans le foie en calcidiol 25 OH D qui est convertie en calcitriol 1:25 dans les reins. Cette dernière est par la suite utilisée pour l’absorption optimale du calcium et du magnésium et l’utilisation dans les os et les cellules.
Schéma expliquant la conversion de la pro vitamine D en calcitriol par l’enzyme vitamin D 25-hydroxylase
● Le MTHFR :
Le gène MTHFr est un gène responsable de la formation d’une enzyme appelé methylenetetrahydrofolate réductase. Cette enzyme est responsable de la conversion de méthylènetétrahydrofolate (vitamine B9) en une forme différente appelée 5-méthyltétrahydrofolate. Il s’agit de la principale forme de folate présente dans le sang et elle est nécessaire pour la transformation de l’acide aminé, l’homocystéine en méthionine qui est nécessaire pour la fabrication des protéines et la modulation des réponses inflammatoires.
La mutation au niveau de gène MTHFr engendre une accumulation d’homocystéine dans le sang qui est corrélé avec l’inflammation chronique et le développement des pathologies neurodégénératives.
Les personnes qui souffrent de mutation dans le gène MTHFR souffrent généralement de carence en 5-méthyltétrahydrofolate et doivent prendre un supplément de B9 sous cette forme, car leur système enzymatique est moins efficace dans la conversion de la VITAMINE B9 d’origine alimentaire.
Ils vont aussi bénéficier de la prise de supplément de vitamine B12 et de Riboflavine (vitamine B2) qui sont des cofacteurs essentiels pour la conversion de l’homocystéine en méthionine, ce qui diminue le risque d’inflammation et de maladies cardiovasculaires [7,8,9].
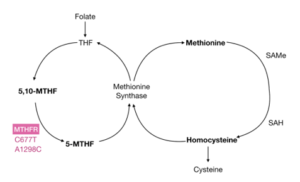
Schéma montrant Le rôle du gène MTHFR dans le métabolisme de la vitamine B9 et dans la conversion de l’homo cystéine en méthionine.
Les maladies associées avec la mutation dans le gène MTHFR sont :
- L’augmentation de risque de maladies cardiovasculaires [10,11].
- L’homocystinurie [12].
- La perte d’audition associée à l’âge.
- Anomalies congénitales : spina bifida.
- Anomalies du tube neural.
● FADS2 :
Le gène FADS2 est un gène qui code pour une enzyme appelée Stearoyl-CoA desaturase S2 qui est responsable de synthèse d’acide gras oméga 3 EPA (l’Acide Eicosapentaénoïque) et DHA (Acide Docosahexaénoïque) à partir de l’acide alpha linolénique. Dans certaines populations, la prévalence de l’allèle rs174570 est associé avec la diminution de l’expression de FADS1 and FADS2, Ce qui induit une diminution dans la conversion de L’ALA en EPA et DHA [13] ce qui se traduit par une carence absolue en acide gras oméga 3. La carence en oméga 3 peuvent entraîner une inflammation chronique et augmenter le risque de développement de maladies neurodégénératives (comme la sclérose en plaque et l’Alzheimer) [14].
Donc les personnes qui souffrent de mutation en FADS2 et une diminution dans l’efficacité de la synthèse d’EPA et DHA doivent soit prendre des compléments d’huile de poisson soit, consommer les poissons gras (saumon, thon, sardines) 2 fois par semaine pour compenser les carences.
● FOXO3 :
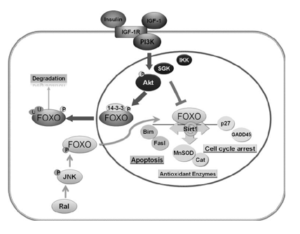
Le FOXO3 : est un facteur de transcription impliqué dans l’activation de plusieurs gènes. Ceux-ci incluent la régulation redox, l’autophagie, l’homéostasie énergétique, la réparation de l’ADN, l’arrêt du cycle cellulaire et l’homéostasie des cellules souches.
Le FOXO3 est un gène qui code un facteur pour une transcription qui joue un rôle très important dans le vieillissement et les phénotypes liés à l’âge, car il régule la réponse au stress, plusieurs variants de FOXO3 sont localisés dans l’intron 2. Il constitue un bloc qui module l’activité des gènes voisins impliqués dans la lutte contre le vieillissement cellulaire [15].
Des études récentes ont révélé que les facteurs de transcription FOXO jouent un rôle clé dans le renouvellement des cellules souches adultes et embryonnaires, ce qui pourrait contribuer à la régénération des tissus adultes. Le FOXO3 contribue aussi avec le facteur NRF2 à l’activation des gènes responsables de la synthèse des enzymes antioxydants comme la catalase, le superoxyde dismutase et le glutathion peroxydase qui nous permettent d’éliminer les radicaux libres surtout durant l’érythropoïèse (la production des globules rouges) [16].
Les mutations au niveau de gène FOXO3 qui induisent une diminution de l’expression du gène induisent une perturbation dans la synthèse des enzymes antioxydantes ce qui diminue l’efficacité de la détoxification cellulaire et accélère le vieillissement prématuré.
Le FOXO3 est activé par un gène appelé sirtuines 1 : que l’on peut l’activer par plusieurs manières :
- Le jeune,
- L’exercice physique,
- L’hormèse : exposition au froid et au chaud (Sauna et cryothérapie),
- Avoir un apport suffisant en vitamines A, C, E et sels minéraux : sodium, magnésium, sélénium, cuivre, zinc,
- Un régime alimentaire équilibré,
- En consommant le resvératrol et la curcumine,
- Une bonne hydratation.
● CMO 1 (pour la conversion de bêta carotène en vitamine A) :
C’est un gène qui code pour une enzyme appelée, β-carotène-15,15′-monooxygénase. Cette enzyme est responsable de la conversion de bêta carotène en rétinol (une forme de vitamine A assimilable par l’organisme). La vitamine A est très importante dans le processus de vision et dans le métabolisme cellulaire et dans la protection de la peau contre le stress oxydatif. Selon un article publié dans le journal de Nutrients, Les mutations qui provoquent la diminution de l’expression de BCMO1 entraîne une hypercaroténémie (accumulation de béta carotène non utilisable par l’organisme) et une déficience sévère en vitamine A [17].
Le régime alimentaire riche en béta carotène (c’est la forme de vitamine A d’origine végétale) et pauvre en rétinol (issue de produits animaux poisson, huile de foie de morue, foie de bœuf) peut entraîner une saturation de l’enzyme CMO1 et entraîner une déficience en vitamine A [17].
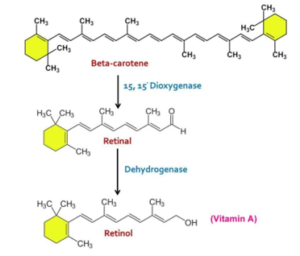
Schéma illustrant la bêta – carotène en rétinol [18]
● NBPF3 :
Neuroblastoma Breakpoint Member 3 (NBPF3) est un gène responsable de la synthèse de NBPF3 qui est une hormone responsable de l’élimination de la vitamine B6 pyridoxine par voie rénale. La vitamine B6 est une vitamine essentielle à l’absorption de magnésium et au fonctionnement du système nerveux. Une carence peut entraîner une augmentation de taux d’homocystéine et l’inflammation.
Les personnes qui présentent des mutations dans le gène NBPF3 peuvent souffrir de carences et ils doivent satisfaire les besoins quotidiens recommandés de 1,3 mg de vitamine B6, en consommant les aliments riches en vitamine B6 comme le foie de bœuf, les abats, le poisson, les pommes de terre, les pois chiches et d’autres fruits secs (sésames, pistaches).
Les mutations dans les domaines UF 1220 localisé dans le gène NBPF3 sont été impliqués dans un certain nombre de maladies neurologiques et cardiaques telles que la microcéphalie, la macrocéphalie, l’autisme, la schizophrénie, les troubles cognitifs, les cardiopathies congénitales, le neuroblastome et les anomalies congénitales des reins et des voies urinaires [19, 20, 21, 22].
● Le gène de glutathion S transférase :
Le gène de GST code pour une série d’enzymes appelé glutathion transférase alpha (GSTA), pi (GSTP), mu (GSTM), et theta (GSTT), qui sont impliqués dans la détoxification de composées toxiques et cancérigènes.
Certains polymorphismes génétiques au niveau de gènes, GSTM1, GSTT1, et GSTP1 réduisent la capacité de détoxification de Glutathion S transférase et augmentent le risque de cancer. Par contre, il a été démontré que certains végétaux crucifères comme le brocoli contiennent des antioxydants qui se décomposent dans la salive pour former le sulforaphane qui stimule l’expression de gènes qui codent pour le glutathion transférase, ce qui diminue le risque de cancer !! [23].
● FUT2 :
Le gène qui code pour la FUT2 se situe sur le chromosome 19 qui est présent en deux exemplaires.
Plusieurs études mettent l’accent sur l’association du gène FUT2 avec le taux de la vitamine B12 circulant dans le sang. Deux de ces études rapportent également des concentrations circulantes de vitamine B12 significativement plus élevées chez les personnes qui présentent des mutations homozygotes pour l’allèle FUT2 appelé allèle non sécréteur commun. Environ 20 % des Caucasiens sont non sécréteurs de l’enzyme en raison des mutations non-sens G428A (rs601338) et C571T (rs492602) au sein des exemplaires maternels et paternels du gène FUT2 [24,25,26].
● Le gène PEMT :
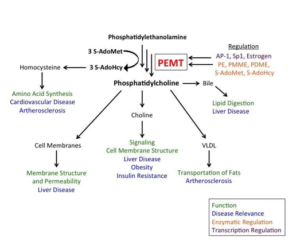
Ce gène est responsable de la conversion de phosphatidylethanolamine en phosphatidyl choline issue de l’alimentation. Certains polymorphismes génétiques dans ce gène sont associés à une déficience en choline et une augmentation dans le risque de développement de la stéatose hépatique. Les individus qui portent ce genre de mutation doivent augmenter leur apport en phosphatidylcholine pour satisfaire leurs besoins journaliers en choline (les jaunes d’œuf sont une bonne source de choline) [27]. Selon une étude publiée dans le journal de biological biochemestry, le gène PEMT est activé par l’œstrogène. La mutation (rs12325817) au niveau du gène qui code pour les récepteurs d’œstrogène au niveau de cellules chez les femmes induit une diminution de l’expression de gène PEMT et augmente le risque de déficience en choline et de stéatose hépatique [28].
Références :
[1] Davignon J, Gregg RE, Sing CF. 1988. Apolipoprotein E polymorphism and atherosclerosis. Arteriosclerosis 8:1–21
[2] Steven Mann,1 Christopher Beedie,2 and Alfonso Jimenez3 Differential Effects of Aerobic Exercise, Resistance Training and Combined Exercise Modalities on Cholesterol and the Lipid Profile: Review, Synthesis and Recommendations Sports Med. 2014; 44(2): 211–221. Published online 2013 Oct 31. doi: 10.1007/s40279-013-0110-5
[3] A Tybjaerg-Hansen 1, S E Humphries Familial defective apolipoprotein B-100: a single mutation that causes hypercholesterolemia and premature coronary artery disease . 1992 Oct;96(2-3):91-107. Review Atherosclerosis doi: 10.1016/0021-9150(92)90056-m.
[4] Pagani F, Giudici GA, Baralle FE, Vergani C. 1992. Association of a polymorphism in the apoA-I gene promoter with hyperalphalipoproteinemia. Eur. J. Epidem. 8:54–58
[5] Tom D. Thacher, Philip R. Fischer, Ravinder J. Singh, Jeffrey Roizen, and Michael A. Levine CYP2R1 Mutations Impair Generation of 25-hydroxyvitamin D and Cause an Atypical Form of Vitamin D Deficiency J Clin Endocrinol Metab. 2015 Jul; 100(7): E1005–E1013. Published online 2015 May 5. doi: 10.1210/jc.2015-1746
[6] Research Genetically low vitamin D concentrations and increased mortality: mendelian randomisation analysis in three large cohorts BMJ 2014; 349 doi: https://doi.org/10.1136/bmj.g6330 (Published 18 November 2014)Cite this as: BMJ 2014;349:g6330
[7] Bhargava S, Ali A, Parakh R, Saxena R, Srivastava LM. Higher incidence of C677T polymorphism of the MTHFR gene in North Indian patients with vascular disease. Vascular. 2012 Apr;20(2):88-95. doi: 10.1258/vasc.2011.oa0320. Epub 2012 Feb 28. Citation on PubMed
[8] Moll S, Varga EA. Homocysteine and MTHFR Mutations. Circulation. 2015 Jul 7;132(1):e6-9. doi: 10.1161/CIRCULATIONAHA.114.013311. Review. Citation on PubMed
[9] Trabetti E. Homocysteine, MTHFR gene polymorphisms, and cardio-cerebrovascular risk. J Appl Genet. 2008;49(3):267-82. doi: 10.1007/BF03195624. Review
[10] Sibani S, Christensen B, O’Ferrall E, Saadi I, Hiou-Tim F, Rosenblatt DS, Rozen R. Characterization of six novel mutations in the methylenetetrahydrofolate reductase (MTHFR) gene in patients with homocystinuria. Hum Mutat. 2000;15(3):280-7. Citation on PubMed
[11] Botto LD, Yang Q. 5,10-Methylenetetrahydrofolate reductase gene variants and congenital anomalies: a HuGE review. Am J Epidemiol. 2000 May 1;151(9):862-77. Review. Citation on PubMed
[12] Yadav U, Kumar P, Yadav SK, Mishra OP, Rai V. « Polymorphisms in folate metabolism genes as maternal risk factor for neural tube defects: an updated meta-analysis ». Metab Brain Dis. 2015 Feb;30(1):7-24. doi: 10.1007/s11011-014-9575-7. Epub 2014 Jul 9. Review.
[13] FADS1-FADS2 genetic polymorphisms are associated with fatty acid metabolism through changes in DNA methylation and gene expression Zhen He, Rong Zhang, Feng Jiang, Hong Zhang, Aihua Zhao, Bo Xu, Li Jin, Tao Wang, Wei Jia, Weiping Jia & Cheng Hu Clinical Epigenetics volume 10, Article number: 113 (2018) Cite this article
[14] Welayah Ali AlAmmar 1, Fatima Hassan Albeesh 1, Layla Makki Ibrahim 1, Yasmin Yussuf Algindan 1, Lamya Zohair Yamani 2, Rabie Yousif Khattab 1 Effect of omega-3 fatty acids and fish oil supplementation on multiple sclerosis: a systematic review Nutr Neurosci . 2021 Jul;24(7):569-579. doi: 10.1080/1028415X.2019.1659560. Epub 2019 Aug 28.
[15] Brian J. Morris,a,b,c D. Craig Willcox,b,d Timothy A. Donlon,b and Bradley J. Willcoxa,b FOXO3 – A Major Gene for Human LongevityGerontology. Author manuscript; available in PMC 2017 Apr 24. Published in final edited form as: Gerontology. 2015; 61(6): 515–525. Published online 2015 Mar 28. doi: 10.1159/000375235
[16] Dragan Marinkovic,1 Xin Zhang,1 Safak Yalcin,1 Julia P. Luciano,1 Carlo Brugnara,2 Tara Huber,1 and Saghi Ghaffari1,3,4,5 Foxo3 is required for the regulation of oxidative stress in erythropoiesis J Clin Invest. 2007 Aug 1; 117(8): 2133–2144. Published online 2007 Aug 1. doi: 10.1172/JCI31807
[17] Annika Lindqvist 1, John Sharvill, Denis E Sharvill, Stefan Andersson Loss-of-function mutation in carotenoid 15,15′-monooxygenase identified in a patient with hypercarotenemia and hypovitaminosis A J Nutr. 2007 Nov;137(11):2346-50. doi: 10.1093/jn/137.11.2346.
[18] http://genomics.unl.edu/RBC_EDU/car.html
[19] decreased serum pyridoxal levels in schizophrenia: meta-analysis and Mendelian randomization analysis.
Tomioka Y, Numata S, Kinoshita M, Umehara H, Watanabe SY, Nakataki M, Iwayama Y, Toyota T, Ikeda M, Yamamori H, Shimodera S, Tajima A, Hashimoto R, Iwata N, Yoshikawa T, Ohmori TTomioka Y, et al. J Psychiatry Neurosci, 2018 May. PMID 29688875
[20] Insertion of an HERV(K) LTR in the intron of NBPF3 is not required for its transcriptional activity. Vandepoele K, van Roy FVandepoele K, et al. Virology, 2007 May 25. PMID 17391723Anion exchanger 2 (AE2) binds to erythrocyte ankyrin and is colocalized with ankyrin along the basolateral plasma membrane of human gastric parietal cells
[21] Jöns T, Drenckhahn DJöns T, et al. Eur J Cell Biol, 1998 Mar. PMID 9587054 Genetic Associations with Plasma B12, B6, and Folate Levels in an Ischemic Stroke Population from the Vitamin Intervention for Stroke Prevention (VISP) Trial
[22] Keene KL, Chen WM, Chen F, Williams SR, Elkhatib SD, Hsu FC, Mychaleckyj JC, Doheny KF, Pugh EW, Ling H, Laurie CC, Gogarten SM, Madden EB, Worrall BB, Sale MMKeene KL, et al. Front Public Health, 2014. PMID 25147783
[23] Lampe JW, Peterson S. 2002. Brassica, biotransformation and cancer risk: genetic polymorphisms alter the preventive effects of cruciferous vegetables. J. Nutr. 132:2991–94
[24] Common variants of FUT2 are associated with plasma vitamin B12 levels. Hazra A, Kraft P, Selhub J, Giovannucci EL, Thomas G, Hoover RN, Chanock SJ, Hunter DJ Nat Genet. 2008 Oct; 40(10):1160-2.
[25] Genome-wide significant predictors of metabolites in the one-carbon metabolism pathway. Hazra A, Kraft P, Lazarus R, Chen C, Chanock SJ, Jacques P, Selhub J, Hunter DJ Hum Mol Genet. 2009 Dec 1; 18(23):4677-87.
[26] Common variants of FUT2 are associated with plasma vitamin B12 levels. Hazra A, Kraft P, Selhub J, Giovannucci EL, Thomas G, Hoover RN, Chanock SJ, Hunter DJNat Genet. 2008 Oct; 40(10):1160-2.
[27] Polymorphism of the PEMT gene and susceptibility to nonalcoholic fatty liver disease (NAFLD). Jiannan Song,1 Kerry Ann da Costa,1 Leslie M. Fischer,1 Martin Kohlmeier,1 Lester Kwock,2 Shuli Wang,1 and Steven H. Zeisel1 FASEB J. Author manuscript; available in PMC 2005 Oct 17. Published in final edited form as: FASEB J. 2005 Aug; 19(10): 1266–1271. doi: 10.1096/fj.04-3580com
[28] Aberrant Estrogen Regulation of PEMT Results in Choline Deficiency-associated Liver Dysfunction*Mary E. Resseguie, Kerry-Ann da Costa, Joseph A. Galanko,§,1 Mukund Patel, Ian J. Davis, ,2,3 and Steven H. Zeisel,3,4 J Biol Chem. 2011 Jan 14; 286(2): 1649–1658. Published online 2010 Nov 8. doi: 10.1074/jbc.M110.106922