Objectifs :
- Introduire le concept de l’hormèse.
- Illustrer les différents types d’hormèse.
Sommaire :
1- Introduction au concept de l’hormèse :
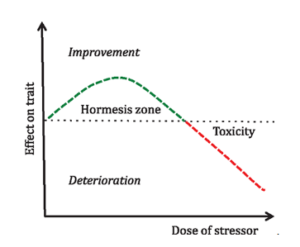
L’hormèse est définie par l’exposition du corps à des agents chimiques à faible dose ou des stimulus physiques (chaud, froid) pendant une courte période qui apporte des bienfaits pour la santé.
Pour vivre en bonne santé physique et mentale, le corps humain a besoin d’être en interaction avec son environnement sous peine de dépérir. C’est le principe universel dans la physique quantique : tout ce qui n’est pas utilisé se dégrade ou dégénère. Le corps humain possède une capacité remarquable dans la lutte contre le stress physiologique, d’où l’intérêt de se soumettre à des stimulus qui renforcent nos capacités adaptatives innées, c’est le principe de l’hormèse : plusieurs formes d’hormèse peuvent exister : la faim (le jeune), l’exercice physique (fatigue), le froid (la cryothérapie) le chaud(le sauna), l’hormèse moléculaire (qui se manifeste par une exposition à des microdoses de molécules toxiques).
En pratiquant une forme d’hormèse chaque jour, on renforce notre système immunitaire, respiratoire et circulatoire. On est plus résistant au stress et à la fatigue, ce qui fait qu’on a plus d’énergie pour accomplir nos tâches quotidiennes et même pour s’amuser !. L’hormèse améliore également nos habilités cognitives et augmentent notre rendement au travail. Il nous apporte un sommeil profond et récupérateur et réduit la dépression et la baisse d’humeur.
L’hormèse constitue un stress physiologique à court terme dont les bienfaits dépendent de la dose, l’hormèse peut avoir des effets néfastes si elle dépasse certain seuil (un exercice physique ou un sauna prolongé).
Schulz, le fondateur de l’hormèse affirme que les milieux biologiques sont différents des milieux chimiques ou physiques. Suite à l’exposition à un agent hormétique, le système biologique subit des réponses bidirectionnelles en fonction de la dose, alors que les systèmes chimiques ou physiques fonctionnaient selon des règles thermodynamiques de manière unidirectionnelle quelle que soit la concentration de réactif. Bien qu’il soit couramment utilisé, le terme hormèse est nouveau. Schulz est généralement considéré comme le fondateur de la théorie de l’hormèse.
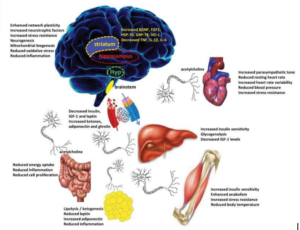
Avec l’évolution de la recherche scientifique dans le domaine de (Multiomics) explorant les effets de l’hormèse sur le plan génétique et épi génétiques et physiologiques. On est capable d’identifier plusieurs mécanismes biologiques complexes qui sont responsables des effets bénéfiques de l’hormèse sur le corps :
-
- L’hormèse favorise la sécrétion de l’adrénaline ce qui permet de booster le système immunitaire.
- L’hormèse en générant des espèces réactives d’oxygène favorise la transcription de facteur NRF2 qui active la synthèse de glutathion peroxydase impliqué détoxification cellulaire [1,2].
- L’hormèse permet de booster notre capacité cognitive de mémoire et de concentration en favorisant la neurogenèse et la neuroplasticité en augmentant la synthèse de BDNF(brain derived neurotrophic factor) [3].
- L’hormèse augmente la circulation sanguine et lymphatique.
- L’hormèse favorise la synthèse de protéines de choc thermique (heat chock protéines) qui protègent les protéines contre l’agrégation.
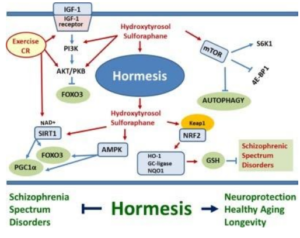
L’exposition à des mircodoses de sulfuraphane (issue de la dégradation enzymatique des isotyocynate de brocoli) et d’hydroxytyrosol issue des feuilles d’olivier est une forme d’hormèse moléculaire qui va activer plusieurs gènes à effet bénéfique pour la santé (AMPK, sirtuines, NRF2) et l’autophagie ce qui aurait des effets bénéfiques sur la neuroinflammation associé aux troubles neuropsychiatriques.
Schéma expliquant les effets bénéfiques de l’hormèse moléculaire et environnementale sur le système nerveux [4].
2- Les différents types d’hormèse et leurs bienfaits :
2-1- L’exposition au froid : la cryothérapie :
La douche froide ou l’exposition à l’eau froide pendant quelque minute à une température de 0 à 15 degré semble être bénéfique pour le Corps. Selon les recherches récentes elle possède plusieurs bienfaits :
Elle augmente la résistance au stress, la circulation sanguine, renforce l’immunité, améliore l’appétit et le sommeil et diminue l’inflammation, stimule la biogenèse mitochondriale et l’activation des gènes de détoxification cellulaire.
Études cliniques sur les bienfaits de la cryothérapie :
- Les bienfaits sur le taux d’enzymes antioxydantes :
Selon une étude Clinique randomisée qui porte sur des jeunes hommes en bonne santé, l’adoption de 20 séances de cryothérapie pendants trois minutes, a provoqué une augmentation de 2 fois dans les concentrations des globules rouges et de l’enzyme antioxydante glutathion après dix séances de cryothérapie, Une autre enzyme antioxydante (le superoxyde dismutase) a augmenté d’environ 43 % par rapport à la valeur de référence lors de la dernière séance [5].
- Les bienfaits anti-inflammatoires :
Selon une étude publiée dans le journal de clinical investigation. La cryothérapie stimule la croissance des tissus adipeux Brun qui sont importants dans la lipolyse et la lutte contre l’obésité et l’inflammation [6], ainsi elle permet d’augmenter la production de l’adiponectine, une hormone impliquée dans la perte du poids. Il est aussi connu que l’exposition au froid exerce des effets anti-inflammatoires. Une étude clinique publiée dans le journal de Plose one a montré que la pratique de l’exposition au froid avant l’exercice physique diminue le taux de marqueurs inflammatoires NE, IL-2, IL-7, IL-12, IL-17, IFN-γ après l’injection des endotoxines ( lipopolysaccharides issue d’une bactérie pathogène E Coli). Cependant, la même étude a montré que l’exercice physique prolongé dans des conditions froides provoque le contraire, une élévation dans le taux des marqueurs inflammatoires [7].
- Les bienfaits sur le système immunitaire :
Selon une étude publiée dans européen journal of applied physiology l’application de l’exposition au froid 14 degré (pendant une heure) pendant 6 semaines induit une augmentation significative de taux de monocytes et de macrophages et de lymphocytes. Cependant, IL1 1beta, neopterin, C-reactive protéine, orosomucoid, céruloplasmine, macroglobuline, n’ont pas changé. Cette étude prouve que l’exposition au froid induit une modulation du système immunitaire par l’intermédiaire de l’augmentation de la production de norépinéphrine [8].
- Les bienfaits sur l’humeur :
Des études montrent que la douche froide peut améliorer les symptômes de troubles neuropsychiatriques comme la dépression, en effet les auteurs d’une étude publiée dans le journal de Médecine hypothesis ont mentionné que l’exposition au froid à 20 degrés pendant 2 minutes 2 fois par jour augmente la production des béta endorphines qui sont des neuromédiateurs qui améliorent les symptômes de la dépression [9] il a été démontré que la cryothérapie augmente la production des norépinéphrine , un neurotransmetteur impliqué dans la vigilance, la concentration et la régulation de l’humeur. La baisse de niveau de ceci entraîne un manque d’attention et il est associée à une altération de l’humeur [10]. Un niveau bas a été associé à une augmentation du risque de dépression [11].
- Les bienfaits sur les performances physiques :
D’autres études ont exploré l’effet de l’exposition du froid sur la récupération musculaire après l’exercice physique. Les chercheurs d’une étude clinique publiée dans le journal de médecine Baltimore ont trouvé que la pratique de l’exposition au froid (12 à 15 degrés) après l’exercice réduit d’une manière significative les courbatures musculaires chez 20 sportifs par rapport au groupe qui ont reçu une séance d’hypno thérapie [12].
Une méta-analyse qui résume les résultats de 9 essais cliniques contrôlés randomisés a exploré l’effet de la cryothérapie sur les douleurs musculaires et la récupération. Les études incluses ont utilisé une immersion dans l’eau froide (sauf le cou et la tête) après la fin de l’exercice dans un bain-marie à des températures de 41 à 59 °F (5 à 15 °C) pendant 5 à 20 minutes. Les différents types d’exercices utilisés sont la course, le vélo ou le saut, Les résultats ont montré que la cryothérapie provoque une amélioration dans la récupération musculaire. La réduction de la douleur musculaire dans le groupe qui a pratiqué la cryothérapie à des températures de l’eau entre 34° et 59°F (11° et 15 °C)’ était environ 50 pour cent plus élevé que ceux utilisant des températures entre 41° et 50°F (5 ° à 10 °C) [13].
- Les études sur la longévité sur les modèles animals :
Les études de l’effet de l’exposition au froid sur la longévité dans les modèles animaux montrent des résultats prometteurs. Une étude a révélé que les mouches vivaient deux fois plus longtemps lorsqu’elles étaient maintenues à une température de 21 °C qu’à 27 °C [14]. En plus, des recherches sur les vers ont révélé qu’une baisse de température de 5 °C augmentait la durée de vie de 75 % [15]. Un certain nombre d’études sur les insectes ont également trouvé une relation négative entre l’élévation de la température ambiante et la durée de vie.
- Les risques associés à la cryothérapie :
La cryothérapie peut avoir des risques graves si elle n’est faite sous supervision. Le risque le plus décrit est l’hypothermie qui se manifeste par une baisse de la température corporelle au-delà de 35 degrés. Les symptômes peuvent varier d’une simple nausée à une confusion et une perte de conscience [16]. La gelure ou engelure, est une brûlure par le froid. Comme la gelure peut être superficielle ou profonde. Elle peut parfois atteindre les muscles et les os. Elle se traduit par une irritation cutanée. Cette complication apparaît généralement lors de l’exposition de la peau à des températures de – 12.2 °C. La personne exposée à des températures de moins de -26 °C pendant plus de 30 minutes peut souffrir d’engelure [17].
L’exposition au froid est contre-indiquée chez les personnes qui souffrent d’hypothyroïdie et ceux qui consomment de l’alcool [18].
2-2- Le sauna :
Le sauna est une pratique courante qui vise à mettre le corps. Dans des conditions hyperthermiques entre 5 à 20 Minutes avec des intervalles de refroidissement. Le sauna est une thérapie hormétique à multiples bienfaits pour la santé. Elle active des mécanismes neuroendocriniens, cardiovasculaires, cytoprotecteurs qui permettent de restaurer l’homéostasie thermique du corps [19]. Elle favorise la Détoxification des métaux lourds par voie cutanée à travers la sueur. Renforce le système immunitaire et stimule la circulation sanguine.
Traditionnellement le sauna a été utilisé en utilisant le bois comme source thermique qui chauffe l’air avec une température qui varie de 70 °C à 100 °C (158°F à 212°F), la température optimale varie entre 80 °C à 90 °C (176°F à 194°F).
Le sauna infrarouge par contre utilise des rayonnements qui chauffent le corps directement et aussi en chauffant l’air, la température de sauna infrarouge varie entre 45 °C à 60 °C (113°F à 140°F) [20]. L’humidité dans les chambres de sauna est de 10 à 20 pourcent.
Plusieurs études ont montré que la pratique d’une séance de sauna réduit le risque de développement de maladies cardiovasculaire, d’alzheimer. La durée de sauna optimale est de 20 minutes à une température de 78.9 °C (174°F). Selon une étude publiée dans le journal JAMA (journal of american medical association) qui porte sur 2315 individus âgés entre 42 et 60 ans, la pratique de sauna (2 à 3 séances par semaine) réduit d’une manière significative le risque de mortalité dû à des maladies cardiovasculaires [21].
Le sauna peut exercer des effets bénéfiques sur le système neuroendocrinien par plusieurs mécanismes :
- En stimulant la synthèse des protéines HSP (heat shock protéines) qui protègent nos enzymes et nos protéines contre l’agrégation [22].
- Il active l’hème oxygénase HO 1 qui va activer le facteur NRF2 impliqué dans la synthèse des enzymes antioxydant (catalase, superoxyde dismutase, glutathion)[23].
- En activant les sirtuines et le FOXO3 (des gènes impliqués dans la réparation de l’ADN et la longévité)[24].
- Selon une étude publiée dans le journal d’Européen Journal of épidémiologie et qui porte sur 2000 individus, la pratique du sauna est inversement corrélé avec le taux élevé de protéine C réactive ce qui prouve que la sauna exerce des effets anti-inflammatoires [25].
Le sauna peut aussi augmenter la neurogenèse en activant la production de la protéine BDNF (brain derived neurotrophic factor) [26] et améliore l’humeur en stimulant la production des bêta endorphines qui se fixent sur les récepteurs opioïdes dans le cerveau et exercent des effets anxiolytiques [27].
En effet, selon une étude clinique randomisée publiée dans le journal de JAMA ( psychiatry) qui porte sur 30 adultes souffrant de dépression, la pratique d’une séance de sauna à 38.5 °C exerce des effets antidépresseurs qui ont persisté 6 semaines après le traitement [28].
Remarque : une hydratation adéquate doit être prise en compte pour minimiser les effets de la perte des électrolytes (sodium, potassium, magnésium, calcium) dans la sueur. Un adulte peut perdre presque 0.5 kg d’eau et de sels minéraux par séance. Ces pertes peuvent entraîner des crampes musculaires et de la fatigue [29]. Ceux qui utilisent le sauna fréquemment (plusieurs fois par semaine) doivent compenser les minéraux en consommant des fluides et des bouillons de légumes et de protéines animales de qualité. Ceux qui n’adoptent pas un régime alimentaire équilibré ou qui adoptent des diètes trop restrictives doivent prendre des compléments nutritionnels de (magnésium, potassium, cuivre, zinc, calcium).
Contre-indications : les enfants moins de 2 ans ont un mécanisme de thermorégulation non encore apte à s’adapter à l’usage du sauna. Cependant l’usage du sauna chez les enfants plus de 2 ans est considéré sécuritaire, mais toujours sous la supervision des parents [30].
Les enfants qui souffrent de troubles du ganglion sino-auriculaire doivent éviter le sauna parce qu’ils risquent d’avoir une hypotension pendant la phase de thermorégulation après le sauna [31]. Les personnes qui sont sous régime médicamenteux ou atteint de la fièvre ou de maladies infectieuses ou cardiovasculaires doivent éviter l’usage du sauna et demander le conseil de leur médecin traitant [32].
2-3- L’exercice physique :
L’exercice physique modéré est considéré comme une thérapie hormétique qui soumet les cellules à un stress physiologique par la génération des espèces réactives d’oxygène qui est bénéfique à court terme. L’organisation mondiale de santé recommande aux personnes atteintes de maladies chroniques comme le diabète de type 2 et l’hypertension de pratiquer entre 150 minutes et 300 minutes d’activité physique aérobique (marche, bicyclette, natation, course à pied) par semaine. C’est l’équivalent de 30 minutes 5 jours par semaine. Aussi, il est souhaitable d’adopter un programme d’entraînement musculaire (exercice de résistance musculaire) 1 à 2 fois par semaine pour prévenir la sarcopénie et les fractures et réduire le risque de maladies cardiovasculaires [33].
Selon une étude publiée dans le journal de frontier in physiology ,l’exercice physique influence plusieurs organes dans le corps par l’intermédiaire des myokines qui permettent la prévention contre les maladies cardiovasculaires et le syndrome métabolique [34].
- Il permet de diminuer l’inflammation grâce à l’augmentation de la production d’interleukine 6.
- Il permet Une diminution de la masse graisseuse blanche, responsable de l’insulino-résistance et augmente la masse musculaire maigre et stimule la formation de tissue adipeux Brun responsable de la lipolyse.
- L’augmentation de la sensibilité de l’organisme à l’insuline, que celle-ci soit sécrétée par l’organisme ou injectée ;
- Il permet de maintenir la fonction des tissus endothéliale cardiovasculaire par la sécrétion de follistatin-like 1 (FSTL1) par les muscles.
- Il permet de protéger contre la dégénérescence des neurones en provoquant la sécrétion de BDNF ( brain derived neurotrophic factor ).
- Il stimule la sécrétion de GLP1 (glucagon like peptide 1) qui est indispensable pour la sécrétion de l’insuline par les cellules bêta du pancréas.
Un article récent publié dans le journal de international journal of molécular science montre que l’exercice physique permet de booster la biogenèse mitochondriale par l’activation du gène PGC1 alpha et permet d’activer les sirtuines qui sont impliquées dans la longévité. Pas seulement ça, il permet aussi de favoriser la détoxification cellulaire en agissant sur les gènes responsables de la synthèse des enzymes antioxydantes comme le FOXO3 [35].
2-4- L’hormèse moléculaire ou chimique :
L’hormèse moléculaire est différente de l’hormèse environnementale. Elle se produit suite à l’exposition du corps à des micro- doses de molécules toxiques qui peuvent activer nos gènes de détoxification comme le NRF2 et le FOXO3 . L’hormèse moléculaire peut être induite par la consommation de molécules appelées phyto-nutriments qui se trouvent essentiellement dans les plantes, fruits et légumes. On peut citer le sulfuraphane (issue de la dégradation enzymatique de isothiocyanate de légumes crucifères) et l’hydroxytyrosol (issue de l’huile d’olive) et la curcumine qui peuvent activer la voie de signalisation NRF2 [36] et le resvératrol (issue de raisin rouge) peuvent activer les sirtuines et le FOXO3 impliquée dans la longévité [37]. La berbérine active le facteur de transcription AMPK impliqué dans la régulation de la glycémie [38]. La capsaïcine (issue du poivron rouge et l’allicin (qui se trouve dans l’ail), le menthol qui se trouve dans la menthe poivrée activent les récepteurs (TRP transient calcium channel réceptor) impliqué dans la vasodilatation, la modulation de la douleur, du Goût et la régulation de la température [39].
Même certains médicaments sont considérés comme des molécules qui exercent des effets hormétiques comme la metformine qui active la voie de signalisation AMPK et la rapamycine qui inhibe la voie de signalisation MTOR ( mechanistic target of rapamycin). Dans ce cas, il faut se référer à un principe connu dans la science de toxicologie qui dit que toute molécule est considérée comme toxique tout dépend de la dose.
L’homéopathie est une médecine alternative développée par le médecin allemand Christian Friedrich Samuel Hahnemann au début du 19ème siècle. La majorité de ces remèdes se présente sous la forme de dilutions exprimées en DH (dilution hahnemannienne au dixième ou décimale) ou CH (dilution hahnemannienne au centième ou centésimale). Les médicaments de l’homéopathie sont considérés comme des molécules qui agissent en stimulant les capacités adaptatives de l’organisme. Plusieurs médicaments homéopathiques sont des molécules toxiques (métaux lourds, molécules pro-oxydantes d’origine végétale) diluées et dynamisées. Prenant l’exemple de Belladona 5 CH qui correspond à 5 dilutions au centième successives d’une teinture-mère de belladone [40].
Remarque : tous les médicaments cités sont sous prescription médicale et seulement votre médecin traitant peut les prescrire.
2-5- L’hormèse par le jeune :
Le jeune est considéré comme une forme d’hormèse. Quel que soit le type de jeune, religieux(jeune musulman), ou jeune intermittent. En arrêtant de manger pendant une période de 14 à 24 heures soumis notre corps à un stress physiologique bénéfique qui favorise la réparation, la régénération, et la détoxification cellulaire.et protège le corps contre le développement de plusieurs maladies chroniques (diabète, hypertension, cancer, maladies neurodégénératives) par l’intermédiaire de modulations épi génétiques complexes qui ont été illustré dans une étude publiée par Dr Volter Longo dans le journal de cell métabolism [41].
Les mécanismes protecteurs de jeune (Journal of cell metabolism) [41].
- Le jeûne favorise l’activation de la voie de signalisation AMPK et augmente par conséquence l’utilisation cellulaire de glucose.
- Le jeûne protège le cœur en diminuant la pression artérielle et en diminuant la fréquence cardiaque au repos.
- Le jeune active les gènes responsables de la détoxification comme les sirtuines et le FOX3.
- Le jeûne augmente la sécrétion de GH (growth hormone).
- Le jeune favorise la réparation de la muqueuse intestinale et l’équilibre du microbiote intestinal.
- Le jeûne réduit l’inflammation et le stress oxydant.
- Le jeune active la biogenèse mitochondriale en activant la PGC1α.
Études cliniques sur l’efficacité du jeûne
Selon une étude clinique randomisée publiée dans le journal de obésity La pratique du jeune chez les individus obèse réduit le taux de l’hormone de la faim (ghreline) et augmente l’oxydation des lipides et favorise la flexibilité métabolique [42].
Selon une étude clinique publiée dans le journal de Nutrients, la pratique du jeûne intermittent de 8 H du matin jusqu’à 2 heures de l’après Midi provoque une réduction significative de la glycémie sur 24 heures, une réduction significative du taux de cortisol pendant le soir, une élévation dans le taux de BDNF, une augmentation dans la concentration sanguine de bêta-hydroxybutyrate, de corps cétonique et une augmentation de l’expression de gènes responsable de l’autophagie de 22% [43].
Une étude clinique publiée dans le journal a exploré l’effet du jeûne sur les paramètres métaboliques chez des patients atteints du syndrome métabolique, l’étude a inclus 13 hommes et 6 femmes, obèses, avec un âge moyen de 59 ans ; 12 des patients avaient une glycémie a jeun élevé et une hémoglobine HbA1c (un biomarqueur du glucose circulant), à un niveau considéré comme pré diabétique. De plus, 16 des patients prenaient des statines ou des médicaments antihypertenseurs. Une application pour téléphone portable a été utilisée pour enregistrer l’apport calorique et surveiller le respect du régime alimentaire pendant 12 semaines.
Les résultats ont montré que la pratique de jeûne de 14 heures durant 12 semaines a provoqué une réduction dans le poids de 3.3 kg, une chute de la pression artérielle, une réduction de cholestérol total de 7 pourcent et de LDL cholestérol de 11 pourcent. Les chercheurs ont conclu que le jeûne intermittent constitue une approche efficace en conjonction avec le traitement médicamenteux pour le syndrome métabolique [44].
Une étude clinique plus large qui inclut 116 participants âgés entre 18 et 64 ans a exploré l’effet de la pratique du jeûne intermittent pendant 16 heures sur les différents paramètres : (glycémie à jeun, hémoglobine glyquée, triglycérides et cholestérol total) : 46 Patients (ont fini l’étude) et qui ont été subdivisés en 2 groupes, un groupe qui a suivi un rythme de jeûne intermittent de 16 heures et un groupe qui a suivi un rythme de 3 repas par jour. Les résultats ont montré qu’il n’y a pas une réduction significative dans le taux de glucose sanguin et le taux d’insuline plasmatique par contre le groupe qui a suivi le jeune a présenté une réduction dans le pourcentage de poids corporel de 20 à 30 pourcent qui est associé à une augmentation dans la production d’adiponectine, l’hormone qui active la lipolyse [45].
Le jeune a prouvé aussi son efficacité dans l’augmentation de la prise de masse musculaire et l’endurance pendant l’exercice physique. En effet, selon une étude clinique publiée dans le journal de Transliational medicine et qui a porte sur 34 adultes sportifs. La pratique du jeûne intermittent durant 15 heures induit une diminution dans le taux de leptine (l’hormone de la faim) et une augmentation dans le taux d’adiponectine. Aussi les résultats ont montré que le jeûne permet de maintenir la masse musculaire maigre et de réduire le pourcentage de graisse corporelle (p = 0.0448) [46].
Références :
[1] Mattson MP. Hormesis defined. Ageing Res Rev. 2008 Jan;7(1):1-7. doi: 10.1016/j.arr.2007.08.007. Epub 2007 Dec 5. PMID: 18162444; PMCID: PMC2248601.
[2] Mattson MP, Maudsley S, Martin B A neural signaling triumvirate that influences ageing and age-related disease: insulin/IGF-1, BDNF and serotonin. Ageing Res Rev. 2004 Nov; 3(4):445-64.
[3] Antioxidant and cytoprotective responses to redox stress. Mathers J, Fraser JA, McMahon M, Saunders RD, Hayes JD, McLellan LI Biochem Soc Symp. 2004; (71):157-76.
[4] Calabrese, V., Giordano, J., Crupi, R., Di Paola, R., Ruggieri, M., Bianchini, R., … Calabrese, E. J. (2016). Hormesis, cellular stress response and neuroinflammation in schizophrenia: Early onset versus late onset state. Journal of Neuroscience Research, 95(5), 1182–1193. doi:10.1002/jnr.23967 .
[5] Lubkowska, Anna, Barbara Dołgowska, and Zbigniew Szyguła. Whole-Body Cryostimulation – Potential Beneficial Treatment for Improving Antioxidant Capacity in Healthy Men – Significance of the Number of Sessions PLoS ONE Edited by Stephane Blanc. 7, no. 10 (October 2012): e46352. https://doi.org/10.1371/journal.pone.0046352.
[6] van der Lans AA, Hoeks J, Brans B, et al. Cold acclimation recruits human brown fat and increases nonshivering thermogenesis. J Clin Invest. 2013;123(8):3395-3403. doi:10.1172/JCI68993.
[7] Gagnon DD, Gagnon SS, Rintamäki H, Törmäkangas T, Puukka K, Herzig K-H, et al. (2014) The Effects of Cold Exposure on Leukocytes, Hormones and Cytokines during Acute Exercise in Humans. PLoS ONE 9(10): e110774. https://doi.org/10.1371/journal.pone.0110774.
[8] Janský L, Pospísilová D, Honzová S, Ulicný B, Srámek P, Zeman V, Kamínková J. Immune system of cold-exposed and cold-adapted humans. Eur J Appl Physiol Occup Physiol. 1996;72(5-6):445-50. doi: 10.1007/BF00242274. PMID: 8925815.
[9] Shevchuk NA. Adapted cold shower as a potential treatment for depression. Med Hypotheses. 2008;70(5):995-1001. doi: 10.1016/j.mehy.2007.04.052. Epub 2007 Nov 13. PMID: 17993252.
[10] Friedman, Joseph I., David N. Adler, and Kenneth L. Davis. The role of norepinephrine in the pathophysiology of cognitive disorders: potential applications to the treatment of cognitive dysfunction in schizophrenia and Alzheimer s disease Biological Psychiatry 46, no. 9 (November 1999): 1243–52. https://doi.org/10.1016/s0006-3223(99)00232-2.
[11] Briley, Mike, and Moret Chantal. The importance of norepinephrine in depression Neuropsychiatric Disease and Treatment , May 2011, 9. https://doi.org/10.2147/ndt.s19619. DOI: 10.1007/1642018164.
[12] Yeung SS, Ting KH, Hon M, et al. Effects of Cold Water Immersion on Muscle Oxygenation During Repeated Bouts of Fatiguing Exercise: A Randomized Controlled Study. Medicine (Baltimore). 2016;95(1):e2455. doi:10.1097/MD.0000000000002455.
[13] Machado, Aryane Flauzino, Paulo Henrique Ferreira, Jéssica Kirsch Micheletti, Aline Castilho de Almeida, Ítalo Ribeiro Lemes, Franciele Marques Vanderlei, Jayme Netto Junior, and Carlos Marcelo Pastre. Can Water Temperature and Immersion Time Influence the Effect of Cold Water Immersion on Muscle Soreness? A Systematic Review and Meta-Analysis Sports Medicine 46, no. 4 (November 2015): 503–14. https://doi.org/10.1007/s40279-015-0431-7.
[14] Miquel J, Lundgren PR, Bensch KG, Atlan H. Effects of temperature on the life span, vitality and fine structure of Drosophila melanogaster. Mech Ageing Dev. 1976 Sep-Oct;5(5):347-70. doi: 10.1016/0047-6374(76)90034-8. PMID: 823384.
[15] Van Voorhies WA, Ward S. Genetic and environmental conditions that increase longevity in Caenorhabditis elegans decrease metabolic rate. Proc Natl Acad Sci U S A. 1999 Sep 28;96(20):11399-403. doi: 10.1073/pnas.96.20.11399. PMID: 10500188; PMCID: PMC18045.
[16] Turk, Elisabeth E. Hypothermia Forensic Science, Medicine, and Pathology 6, no. 2 (February 2010): 106–15. https://doi.org/10.1007/s12024-010-9142-4.
[17] Murphy, James V., Paul E. Banwell, Anthony H. N. Roberts, and D. Angus McGrouther. Frostbite: Pathogenesis and Treatment The Journal of Trauma: Injury, Infection, and Critical Care 48, no. 1 (January 2000): 171. https://doi.org/10.1097/00005373-200001000-00036.
[18] Mittag, Jens. More Than Fever – Novel Concepts in the Regulation of Body Temperature by Thyroid Hormones Experimental and Clinical Endocrinology & Diabetes 128, no. 06/07 (October 2019): 428–31. https://doi.org/10.1055/a-1014-2510.
[19] Laukkanen, Jari A., Tanjaniina Laukkanen, and Setor K. Kunutsor. Cardiovascular and Other Health Benefits of Sauna Bathing: A Review of the Evidence Mayo Clinic Proceedings 93, no. 8 (August 2018): 1111–21. doi:10.1016/j.mayocp.2018.04.008.
[20] Beever, R. Far-infrared saunas for treatment of cardiovascular risk factors: summary of published evidence Can Fam Physician 55, no. 7 (July 2009): 691–96.
[21] Aukkanen, Tanjaniina, Hassan Khan, Francesco Zaccardi, and Jari A. Laukkanen. Association Between Sauna Bathing and Fatal Cardiovascular and All-Cause Mortality Events JAMA Internal Medicine 175, no. 4 (April 2015): 542. doi:10.1001/jamainternmed.2014.8187.
[22] Guchi, Masaki, Andrew E. Littmann, Shuo-Hsiu Chang, Lydia A. Wester, Jane S. Knipper, and Richard K. Shields. Heat Stress and Cardiovascular, Hormonal, and Heat Shock Proteins in Humans Journal of Athletic Training 47, no. 2 (March 2012): 184–90. https://doi.org/10.4085/1062-6050-47.2.184.
[23] Shaw-Fang, Luis G. Melo, Matthew D. Layne, and Mark A. Perrella. Heme Oxygenase 1 in Regulation of Inflammation and Oxidative Damage Methods in Enzymology In , 163–76. Elsevier, 2002. doi:10.1016/s0076-6879(02)53046-9.
[24] Brunet, A. Stress-Dependent Regulation of FOXO Transcription Factors by the SIRT1 Deacetylase Science 303, no. 5666 (March 2004): 2011–15. doi:10.1126/science.1094637.
[25] Laukkanen, Jari A., and Tanjaniina Laukkanen. Sauna bathing and systemic inflammation European Journal of Epidemiology 33, no. 3 (December 2017): 351–53. doi:10.1007/s10654-017-0335-y.
[26] Kojima, Daisuke, Takeshi Nakamura, Motohiko Banno, Yasunori Umemoto, Tokio Kinoshita, Yuko Ishida, and Fumihiro Tajima. Head-out immersion in hot water increases serum BDNF in healthy males International Journal of Hyperthermia 34, no. 6 (November 2017): 834–39. doi:10.1080/02656736.2017.1394502.
[27] Ezova, D., M. Vigas, P. Tatar, J. Jurcovicova, and M. Palat. Rise in plasma beta-endorphin and ACTH in response to hyperthermia in sauna Horm. Metab. Res. 17, no. 12 (December 1985): 693–94.
[28] Anssen, Clemens W., Christopher A. Lowry, Matthias R. Mehl, John J. B. Allen, Kimberly L. Kelly, Danielle E. Gartner, Angelica Medrano, et al. Whole-Body Hyperthermia for the Treatment of Major Depressive Disorder JAMA Psychiatry 73, no. 8 (August 2016): 789. doi:10.1001/jamapsychiatry.2016.1031.
[29] Sawka, Michael N, and Scott J Montain. Fluid and electrolyte supplementation for exercise heat stress The American Journal of Clinical Nutrition 72, no. 2 (August 2000): 564S–572S. doi:10.1093/ajcn/72.2.564s.
[30] JOKINEN, EERO, and ILKKA VÄLIMÄKI. Children in Sauna: Electrocardiographic Abnormalities Acta Paediatrica 80, no. 3 (March 1991): 370–74. doi:10.1111/j.1651-2227.1991.tb11864.x.
[31] Jokinen, E., I. Valimaki, K. Antila, A. Seppanen, and J. Tuominen. Children in sauna: cardiovascular adjustment Pediatrics 86, no. 2 (August 1990): 282–88.
[32] Kukkonen-Harjula, Katriina, and Kyllikki Kauppinen. Health effects and risks of saunabathing International Journal of Circumpolar Health 65, no. 3 (July 2006): 195–205. doi:10.3402/ijch.v65i3.18102.
[33] https://www.who.int/fr/news-room/fact-sheets/detail/physical-activity.
[32] Hassan M, Aguib Y, Yacoub M. Molecular mechanisms of cardiovascular benefits of exercise: Running for cover from heart disease. Glob Cardiol Sci Pract. 2016;2016(1):e201603. Published 2016 Mar 31. doi:10.21542/gcsp.2016.3.
[33] Vargas-Ortiz K, Pérez-Vázquez V, Macías-Cervantes MH. Exercise and Sirtuins: A Way to Mitochondrial Health in Skeletal Muscle. Int J Mol Sci. 2019;20(11):2717. Published 2019 Jun 3. doi:10.3390/ijms20112717.
[34] Nrf2 as a novel molecular target for chemoprevention. Lee JS, Surh YJ Cancer Lett. 2005 Jun 28; 224(2):171-84.
[35] Vargas-Ortiz K, Pérez-Vázquez V, Macías-Cervantes MH. Exercise and Sirtuins: A Way to Mitochondrial Health in Skeletal Muscle. Int J Mol Sci. 2019;20(11):2717. Published 2019 Jun 3. doi:10.3390/ijms20112717.
[36] Frescas D, Valenti L, Accili D Nuclear trapping of the forkhead transcription factor FoxO1 via Sirt-dependent deacetylation promotes expression of glucogenetic genes. J Biol Chem. 2005 May 27; 280(21):20589-95.
[37] Gertz M, Nguyen GT, Fischer F, Suenkel B, Schlicker C, Fränzel B, Tomaschewski J, Aladini F, Becker C, Wolters D, Steegborn C. A molecular mechanism for direct sirtuin activation by resveratrol. PLoS One. 2012;7(11):e49761. doi: 10.1371/journal.pone.0049761. Epub 2012 Nov 21. PMID: 23185430; PMCID: PMC3504108.
[38] Jin Y, Liu S, Ma Q, Xiao D, Chen L. Berberine enhances the AMPK activation and autophagy and mitigates high glucose-induced apoptosis of mouse podocytes. Eur J Pharmacol. 2017 Jan 5;794:106-114. doi: 10.1016/j.ejphar.2016.11.037. Epub 2016 Nov 22. PMID: 27887947.
[39] Bautista DM, Movahed P, Hinman A, Axelsson HE, Sterner O, Högestätt ED, Julius D, Jordt SE, Zygmunt PM Pungent products from garlic activate the sensory ion channel TRPA1.
Proc Natl Acad Sci U S A. 2005 Aug 23; 102(34):12248-52.
[40] Dei A, Bernardini S. Hormetic effects of extremely diluted solutions on gene expression. Homeopathy. 2015 Apr;104(2):116-22. doi: 10.1016/j.homp.2015.02.008. Epub 2015 Mar 21. PMID: 25869976.
[41] Longo VD, Mattson MP. Fasting: molecular mechanisms and clinical applications. Cell Metab. 2014;19(2):181-192. doi:10.1016/j.cmet.2013.12.008.
[42] Ravussin E, Beyl RA, Poggiogalle E, Hsia DS, Peterson CM. Early Time-Restricted Feeding Reduces Appetite and Increases Fat Oxidation But Does Not Affect Energy Expenditure in Humans. Obesity (Silver Spring). 2019 Aug;27(8):1244-1254. doi: 10.1002/oby.22518. PMID: 31339000; PMCID: PMC6658129.
[43] Jamshed, Humaira, Robbie A. Beyl, Deborah L. Della Manna, Eddy S. Yang, Eric Ravussin, and Courtney M. Peterson. Early Time-Restricted Feeding Improves 24-Hour Glucose Levels and Affects Markers of the Circadian Clock, Aging, and Autophagy in Humans Nutrients 11, no. 6 (May 2019): 1234. https://doi.org/10.3390/nu11061234.
[44] Wilkinson, Michael J., Emily N.C. Manoogian, Adena Zadourian, Hannah Lo, Savannah Fakhouri, Azarin Shoghi, Xinran Wang, et al. Ten-Hour Time-Restricted Eating Reduces Weight, Blood Pressure, and Atherogenic Lipids in Patients with Metabolic Syndrome Cell Metabolism 31, no. 1 (January 2020): 92–104.e5. https://doi.org/10.1016/j.cmet.2019.11.004.
[45] Moro T, Tinsley G, Bianco A, Marcolin G, Pacelli QF, Battaglia G, Palma A, Gentil P, Neri M, Paoli A. Effects of eight weeks of time-restricted feeding (16/8) on basal metabolism, maximal strength, body composition, inflammation, and cardiovascular risk factors in resistance-trained males. J Transl Med. 2016 Oct 13;14(1):290. doi: 10.1186/s12967-016-1044-0. PMID: 27737674; PMCID: PMC5064803.
[46] Moro T, Tinsley G, Bianco A, Marcolin G, Pacelli QF, Battaglia G, Palma A, Gentil P, Neri M, Paoli A. Effects of eight weeks of time-restricted feeding (16/8) on basal metabolism, maximal strength, body composition, inflammation, and cardiovascular risk factors in resistance-trained males. J Transl Med. 2016 Oct 13;14(1):290. doi: 10.1186/s12967-016-1044-0. PMID: 27737674; PMCID: PMC5064803.